本文系生物谷原創編譯,歡迎分享,轉載須授權!
黑色素瘤通常是由暴露於陽光下的紫外線(UV)觸發的,這是因為紫外線暴露會破壞DNA,產生導致皮膚細胞增殖和擴散的基因突變。通常,這些細胞產生良性痣,即色素沉著的皮膚生長,但是這種生長在大小上是受到自我限制的。儘管大多數痣從不會變成癌症,但是有些痣能夠轉化為惡性黑色素瘤,並且快速地擴散到身體的其他部位。如果黑色素瘤在早期就能夠被發現,它們幾乎總是能夠被成功治療,但是僅不到30%的轉移性黑色素瘤患者存活超過五年,這就使得黑色素瘤成為一種最致命性的皮膚癌。
如今,在一項新的研究中,美國加州大學舊金山分校的研究人員在一大群人類皮膚癌患者中鑒定出將良性痣轉化為惡性黑色素瘤的基因變化順序,並且在實驗室中利用CRISPR基因編輯在正常人類皮膚細胞中逐步地重建黑色素瘤進化步驟。他們鑒定出的關鍵性分子預警信號可能被臨床醫生用來在黑色素瘤擴散之前捕捉到它們,並且還可能導致人們開發出新的靶向療法。

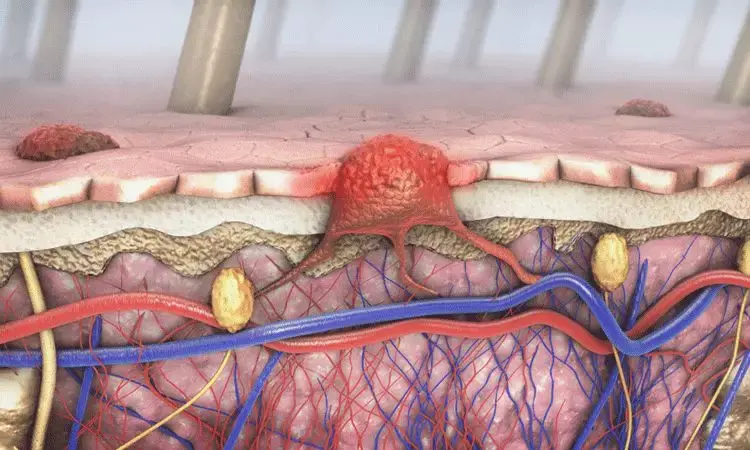
圖片來自圖片來自National Cancer Institute/Wikimedia Commons。
這項新的研究以兩篇論文的形式發表在2018年7月9日的Cancer Cell期刊上。它首次系統性地追蹤了新的突變和基因活性變化如何破壞細胞保護性機制,從而允許良性痣轉化為黑色素瘤並開始擴散。這項新研究還確定了可用於臨床的新型生物標誌物,以便更可靠地檢測快速進展的黑色素瘤。快速進展的黑色素瘤需要在手術切除之外接受進一步的治療。
皮膚科醫生當前通過獲取發生可疑的皮膚生長的活組織樣本來診斷黑色素瘤。如果這種病變經證實是黑色素瘤的話,那麼病理學家就會測量它的厚度以確定它的進展程度以及僅採取手術切除是否足以清除這種癌症:黑色素瘤越厚,它已開始擴散到身體其他部位的風險就越大。但這種方法不是很可靠---一些薄的黑色素瘤也會發生轉移,而一些厚的黑色素瘤可能並不會發生轉移。
長官這項新研究的加州大學舊金山分校海倫-迪勒綜合癌症中心臨床癌症基因組學實驗室主任Boris Bastian博士說,「這是對腫瘤的進展狀態進行非常粗略的評估。我們想要能夠測量良性痣的遺傳狀態來評估它轉化為惡性腫瘤的風險,但是這種轉變的生物學機制還未得到完全理解。」
在第一篇論文中,在加州大學舊金山分校癌症遺傳學家Hunter Shain博士的長官下,這些研究人員研究了一個獨特的數據集:對82名患者進行手術切除獲得的黑色素瘤組織樣本,並且對這些患者所患的惡性腫瘤和良性痣樣本進行並行保存。在一部分患者中,這些研究人員還在已形成轉移性黑色素瘤細胞集落的皮膚中獲得相匹配的轉移性黑色素瘤和原發性黑色素瘤樣本。通過分析這230個組織樣本,這些研究人員能夠比較同一患者中的良性生長、惡性黑色素瘤和轉移性集落之間的分子差異。
這些研究人員對腫瘤DNA進行了測序,以確定在癌症進化的不同階段出現的基因突變,並且測量了RNA的變化,將這些突變與相關的基因活性變化相關聯在一起。Shain說,「這是首次對從來自同一患者的相匹配的黑色素瘤樣本和良性痣中的DNA和RNA進行分析。」
Bastian 補充道,「與加州大學舊金山分校的大型衛生皮膚病學服務機構的密切合作使得開展這項研究成為可能。你能夠同時觀察到良性痣和由它產生的黑色素瘤的混合樣本並不是常見的,但是從我們診斷出的數千例黑色素瘤病例中,我們能夠選擇合適的病例,讓我們研究這種癌症是如何產生的。」
這些研究人員發現,隨著黑色素瘤的進展,多個獨立的基因突變反覆地調整控制細胞生長、腫瘤抑製和DNA調節的關鍵性分子通路,直到足夠的突變積累著,這才破壞細胞的天然保護性機制並觸發癌症。
Shain的團隊在早前的研究中指出黑色素瘤中的MAP激酶通路的早期激活。基於此,Shain說,「這個領域傾向於過度簡化癌症的進化過程,就像僅有一個開關被打開一樣。如今,我們觀察到這個通路在早期僅開啟一點點,隨後在腫瘤進展過程中,它的開啟會逐漸增加。我們認為這可能會讓癌症避免拉響細胞警報,直到足夠多的基因突變遺積累著,這時細胞警報已不再發揮功能。」
在其他的研究發現中,這些研究人員發現作為良性痣向惡性腫瘤轉變的一個關鍵步驟,良性痣中的SWI/SNF類DNA調節基因會發生突變,這提示著這種標誌物可能能夠用於臨床鑒定需要治療的危險痣。
在第二篇論文中,在加州大學舊金山分校黑色素瘤遺傳學家Robert Judson博士的長官下,這些研究人員進行了一項創新性實驗:在受控的實驗室環境中,重建黑色素瘤進化的步驟。通過使用CRISPR-Cas9基因編輯,這些研究人員將他們在臨床標本中觀察到的依次發生的突變精確地插入到正常的人體皮膚細胞中。
這使得這些研究人員能夠研究黑色素瘤進化過程中的每個步驟的特定生物學影響:比如,他們吃驚地發現破壞關鍵性腫瘤抑製基因CDKN2A的突變並不像之前預測的那樣僅是促進腫瘤生長,而且還會通過激活轉錄因子BRN2導致受影響的細胞具有高度的遷移性(因此更容易侵入和擴散到身體的其他部位)。
除了鑒定出促進黑色素瘤進化出致命性的轉移能力的關鍵機制之外,這項新研究還展示了CRISPR基因編輯作為一種研究黑色素瘤的實驗室工具的新用途。
Judson說,「之前的研究通常使用來自晚期癌症的細胞系,然而這些細胞系在遺傳水準上發生了很多差錯,因此很難知道是什麼導致腫瘤轉移。在這項新的研究中,我們研究了除了導入的特定突變之外其他方面都正常的健康皮膚細胞。因此每種突變發揮的作用就會更加一目了然。」
Shain補充道,「如果你到細胞系庫去,那麼你將永遠找不到痣細胞系。Judson的方法允許我們能夠比以往更好地研究黑素瘤前兆(即良性痣)的生物學特性。」
這些研究人員希望這種新工具和利用它獲得的這些發現會將極大地加快研究如何更快地診斷和治療黑色素瘤患者。特別地,他們希望他們的發現能夠快速地被納入到臨床基因測試中,這將使得醫生能夠快速地評估患者患上皮膚癌的風險,並對那些風險最高的人進行早期治療。
Bastian說,「鑒於我們還沒有工具來確定哪些人有較高的發生腫瘤轉移的風險,我們傾向於認為每一個人都具有較高的風險,這會讓他們接受強化治療並遭受潛在的副作用。我們期待通過在加州大學舊金山分校研究黑色素瘤樣本中的基因變化將讓我們能夠鑒定出已進展到危險狀態並且需要更早地接受全身治療的黑色素瘤,這將會提高對患者的治療效果。」
原始出處:
Innovative CRISPR study recreates genetic steps required for benign moles to turn malignant
A. Hunter Shain, Nancy M. Joseph, Richard Yu et al. Genomic and Transcriptomic Analysis Reveals Incremental Disruption of Key Signaling Pathways during Melanoma Evolution. Cancer Cell, 9 July 2018, 34(1):45–55, doi:10.1016/j.ccell.2018.06.005.
Hanlin Zeng, Aparna Jorapur8, A. Hunter Shain et al. Bi-allelic Loss of CDKN2A Initiates Melanoma Invasion via BRN2 Activation. Cancer Cell, 9 July 2018, 34(1):56–68, doi:10.1016/j.ccell.2018.05.014

谷君深情說
黑色素瘤與黑痣的區別對照:

點擊標題查看往期精彩
優酪乳對機體健康有什麼好處?
50年前名噪一時的「中國餐館綜合症」是個什麼病?
近期2型糖尿病領域研究新進展!
Cancer Res:西安交大學者發現抑製甲狀腺癌發生的重要因子
超級實用的生物谷目錄欄找不到了?戳這裡!