百濟神州美股、港股雙重上市 國內PD-1市場進入搶佔適應症賽道
21世紀經濟報導 盧杉 上海報導
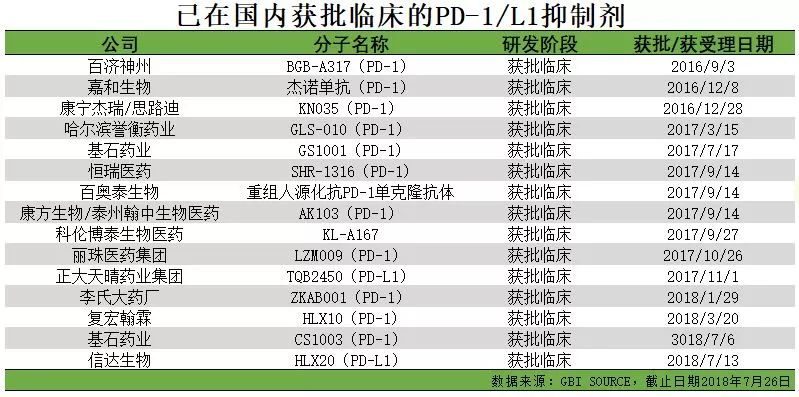
2018年也被認為是國內第一個PD-1/L1藥物上市的時間點。國內多家企業提交了各自單抗產品的申報,均已被納入優先審評程式。
中國的PD-1市場越來越精彩了。繼2016年2月在美國納斯達克上市後,2018年7月27日,中國生物技術公司百濟神州宣布登陸港交所並公布募股發行計劃。
“我們確實希望更多的中國投資者和亞洲投資者參與,百濟神州到現在為止從股東結構上看,很多是美國、歐美的生物技術專業的投資者。”7月29日,百濟神州首席財務官兼首席戰略官梁恆在接受21世紀經濟報導記者採訪時表示,“在開始進入商業階段以後,我們覺得中國和亞洲的投資者對中國的商業市場更加了解,在香港上市確實有希望讓更多的中國和亞洲投資者來參與的考慮。”
百濟神州(06160.HK)此次基礎發行規模為6560萬普通股,其中包括香港發售590.4萬股及國際發售5969.6萬股股份;佔經擴大股本的8.55%,綠鞋股份比例為15%;基礎發行額在62億港元至73億港元之間(相當於7.9億美元至9.3億美元),價格區間為94.40至111.60港元;香港公開發售於7月30日至8月2日進行,並將在2018年8月8日正式敲鑼上市。
百濟神州將成為首個在美股和港股同時上市的中國生物醫藥公司,另外,此次在香港為主要上市(primary listing)而非第二次上市(secondary listing)。
這也是繼港交所今年4月落地上市新規後第二家赴港敲鍾的生物技術公司。對於此次雙重上市的意義,7月29日百濟神州創始人、董事長兼首席執行官歐雷強在香港上市新聞發布會上表示,“全世界有很多投資者專長是生物科技,但他們對中國市場了解極少;又有很多投資人了解中國市場但卻不了解生物技術,所以雙重上市能夠對這兩批人都起到一個教育意義,因為我們想對技術、技能進行一個整合,這樣才能夠建立一個良性的生態圈。”
上市起跑線
據悉,此次募資金額的75%將用於多項核心計劃,包括zanubrutinib(32.5%)、tislelizumab(32.5%)和pamiparib(10%),分別用於各自的臨床試驗、在中國和美國的審批和商業化;另外15%將用於合作和擴充資金;10%用作營運資金、拓展內部能力及一般企業目的。
百濟神州在納斯達克上市兩年半期間做過三次增發,市值從7億美元到目前已經超過90億美元。
今年1月,百濟神州宣布新一輪公開募股完成,毛收入約為8億美元。短時間內再次募股,除了政策的放開,梁恆表示,一是來源於研發管線的進展和數據;二是與新基的合作使之正式進入商業化進程,三是“也在準備其他產品上市,包括內部管線產品,所以需要強化公司的品牌和知名度,在香港上市也對這一方面會有一定的幫助”。
百濟神州創始人王曉東對21世紀經濟報導記者表示,“百濟的PD-1跟其它現有的PD-1比起來,我們從科學上認為是有改進的。我們現在PD-1臨床試驗上了招募了超過1500個病人,這麽多臨床試驗其中一個目的就是想看通過臨床前的科學設計,相比於現有的PD-1所做的改進,能夠在哪一個適應症上表現出來。”
百濟神州目前的產品包括六種內部開發、臨床階段的候選藥物,以及五種藥物及在研藥物的授權許可,包括三種已於中國銷售的由新基獨家授權的藥物ABRAXANE®、REVLIMID®及VIDAZA®,及兩種臨床階段的在研藥物。
梁恆向21世紀經濟報導記者確認,“PD-1和BTK兩個產品我們計劃今年在中國申報,BTK計劃明年上半年在美國申報。BTK抑製劑的開發策略是全球發展,最近在美國被授予了快速通道,會幫助加速上市申請。”
根據百濟神州2017及2018一季度財報,2017年度收入為2.38億美元,2016 年同期分別為107萬美元,截至2018年3月31日,第一季度收入為3254萬美元,同期無收入,增長均來源於與新基公司合作帶來的產品收入和合作收入,其中第一季度產品收入2325萬美元。
搶佔適應症
百濟神州的此次上市也被認為是正面應對國內PD-1市場競爭的開始。
根據Frost and sullivan預測,BTK抑製劑在2025年預計全球市場可達138億美金;PD-1類藥物在2025年全球市場可以達到574億,在中國市場可超過120億美元。
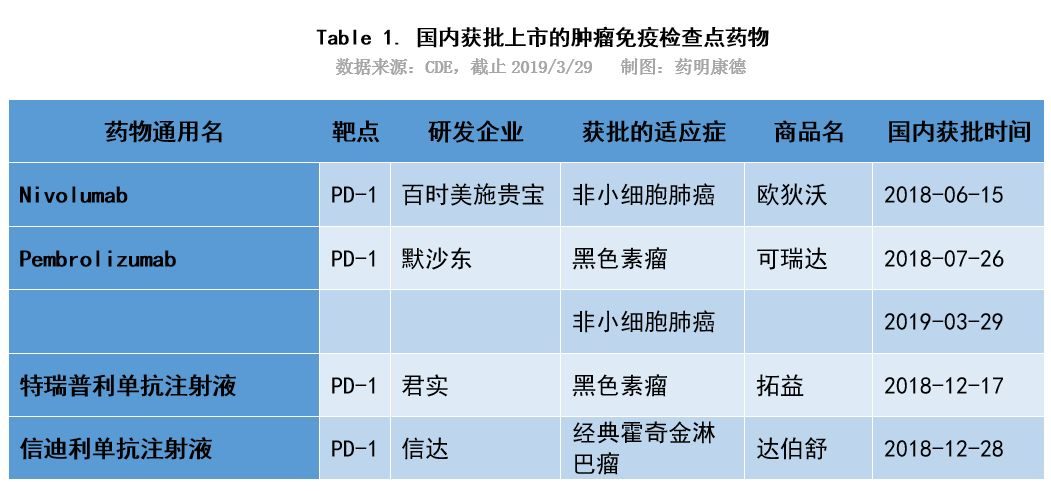
2018年7月26日,默沙東宣布旗下PD-1抑製劑藥物Keytruda(K藥)帕博利珠單抗(Pembrolizumab)正式獲得國家藥品監督管理局的上市批準,用於經一線治療失敗的不可切除或轉移性黑色素瘤的治療,刷新了藥監審評審批速度紀錄。
6月15日,CFDA正式批準國內首個PD-1抑製劑,BMS藥品Opdivo(O藥)納武利尤單抗注射液(Nivolumab)上市,治療部分非小細胞肺癌(NSCLC)成人患者。Opdivo從遞交上市到獲批歷時約7個月,而Keytruda歷時5個多月,上市速度不斷加快。
隨著PD-1在藥監部門審評審批上的路徑越來越清晰,國內的第一梯隊們也紛紛站在了上市起跑線上。2018年也被認為是國內第一個PD-1/L1藥物上市的時間點。
對於上市後的格局和競爭,百濟神州中國區總經理兼公司總裁吳曉濱在接受21世紀經濟報導記者採訪時表示,“現在國家藥監局在企業遞交申請以後批得很快,我想強調的是不僅上市時間重要,更重要的是適應症。我們當前在中國和全球正在進行或計劃開展的臨床研究數量達到50余個,它未來的適應症一定不少;它正在進行全球試驗,這意味著美國、歐盟和全球可能都會拿到同樣的適應症,這和單在中國做試驗是一個巨大的區別。”
另外在價格和醫保上,吳曉濱認為,國家未來在進醫保及報銷上會非常積極主動減輕癌症患者的負擔,“進入社保一定是根據獲批的適應症,所以以後市場競爭很大程度上取決於你有幾個適應症獲批,且這些適應症是中國獲批還是全球獲批、美國歐洲都獲批很重要。而如何獲批適應症在很大程度取決於做了多少臨床實驗、怎麽做的、在哪做的。”
也有觀點認為為了搶佔市場企業會通過超適應症售賣,吳曉濱對此表示,“廠家是不能主動推廣的,但是如果醫生根據實際需求,有國際上發表的文章、臨床實驗的結果證明藥物有效,是可以的,但一定是醫生主動自願,這一點是合規問題。”
對於後續產能,王曉東介紹,“一是和勃林格殷格翰合作,在上海有一條商業生產線。二是我們在廣州正在建設的生產基地總體量24000升,分為三期建設,我們現在一期四個2000升的生產線已經在安裝。”
(編輯:李清宇)
責任編輯:馬婕