自從1847年英國病理學家Vogel J首先描述動脈粥樣硬化(atherosclerosis,AS)斑塊記憶體在膽固醇以來,AS一直被認為是血清膽固醇滲入管壁所致的脂質沉積性病變。有趣的是,時隔11年,德國病理學家Virchow R就指出某些AS病變具有活動性炎症的性質,但這種觀點始終未受到重視。2017年,CANTOS研究的成功,開啟了AS抗炎治療的大門,宣告AS的治療進入了一個新時代。本文將回顧AS炎症假說的簡史和現狀,概述我國學者在這一領域中的貢獻,展望AS抗炎治療的前景。
AS炎症假說的簡史和現狀
1858年,Virchow R在其著作中做了如下描述:"在某些急性病例,動脈壁變軟的表現來自於炎症而非真正的脂質沉積""在炎症部位出現脂肪變性的細胞如此之多,這提供了足夠的證據,在炎症過程中這種轉變必定發生,不應視為被動過程"。遺憾的是,這些早期觀察並未受到足夠重視,在長達一個多世紀的時間裡,AS一直被認為是被動性脂質沉積所導致的病變。20世紀60至70年代,美國病理學家Ross R提出了損傷-反應學說,認為血管平滑肌細胞對於血管內皮細胞損傷後的增生反應是導致AS的主要發病機制。20世紀80年代,單克隆抗體技術的出現,使人們認識到單核-巨噬細胞是泡沫細胞的主要來源,20世紀80至90年代細胞間黏附因子(ICAM)和血管間黏附因子(VCAM)的發現揭示了血管內皮細胞在AS炎症反應中的重要地位。美國血管生物學家Libby P團隊在AS炎症因子的研究領域中做出突出貢獻,他們在1992年發現斑塊中的巨噬細胞集落刺激因子可誘導巨噬細胞的清道夫受體攝取氧化修飾的低密度脂蛋白膽固醇(LDL-C),1994年發現人類AS斑塊有金屬蛋白酶的過表達和膠原的降解,1998年發現單核細胞趨化蛋白-1缺失可減輕AS病變。這些發現促使Ross R修改了他的損傷-反應學說,於1999年提出了AS發病的炎症學說,他指出儘管在大約50%的心血管病患者中高膽固醇血症是重要的,但亦須考慮其他因素。AS顯然是一個炎症性疾病,而不單純由於脂質沉積所致。如果我們能夠選擇性改變動脈中有害的炎症成分而不損傷免疫功能,我們就可能在50%無高膽固醇血症的心血管病患者中開闢診斷和治療AS的新途徑。18年來的大量基礎和臨床研究不斷為這一假說提供了新的證據,研究發現單核細胞、巨噬細胞、T淋巴細胞、抗原遞呈細胞、肥大細胞、血管內皮細胞、血管平滑肌細胞等參與了AS炎症反應。為了使這些基礎研究儘快轉化為臨床應用,學者們開始致力於尋找人類AS的炎症標誌物,美國Ridker PM團隊發現C反應蛋白(CRP)可預測無癥狀人群的心血管事件,他長官的JUPITER臨床試驗證明,在無癥狀人群中他汀降低心血管事件的獲益來源於降脂和抗炎兩方面的療效。雖然基礎研究發現了多個AS相關性炎症因子,但近年興起的孟德爾隨機臨床研究否定了大多數炎症因子與冠心病的因果關係。儘管如此,孟德爾隨機研究的匯總分析發現,刺激CRP產生的上遊因子白細胞介素(IL)-6與冠心病的發生具有因果關係,提示IL-6可作為AS抗炎治療的靶點。IL-6的主要作用是刺激肝臟產生CRP、纖維蛋白原和纖溶酶原激活物抑製劑,從而促進炎症和凝血,但意外的是,IL-6受體拮抗劑托珠單抗(tocilizumab)可導致患者LDL-C升高,因而不利於AS的治療。由於IL-6的上遊調控因子是IL-1,這一靶點迅速引起了人們的關注。IL-1是最主要的固有免疫誘導劑之一,具有誘導自身表達增加的正反饋效應,主要作用是促進下遊炎症因子IL-6的大量產生,進而刺激血管內皮細胞分泌VCAM-1、ICAM-1和單核細胞趨化蛋白(MCP)-1,刺激血管平滑肌細胞分泌血小板生長因子(PDGF)而促進平滑肌細胞增殖和遊移,刺激巨噬細胞釋放基質金屬蛋白酶(MMP)而導致斑塊破裂。IL-1分為IL-1α和IL-1β兩個亞型,IL-1α大部分與細胞膜結合,而IL-1β是循環中可溶性IL-1的主要形式,AS斑塊中的NLRP3炎症小體可激活半胱天冬酶caspase-1,後者將相對分子品質33 000的IL-1前體(pro-IL-1β)剪切為相對分子品質17 000的具有活性的IL-1β。近年來,Ridker PM團隊研製成功了人源性抗IL-1β單克隆抗體卡納單抗(canakinumab),Ⅱ期臨床試驗顯示,卡納單抗可明顯降低臨床患者的血漿IL-6和CRP水準而不影響LDL-C,這導致了CANTOS研究的設計和啟動。
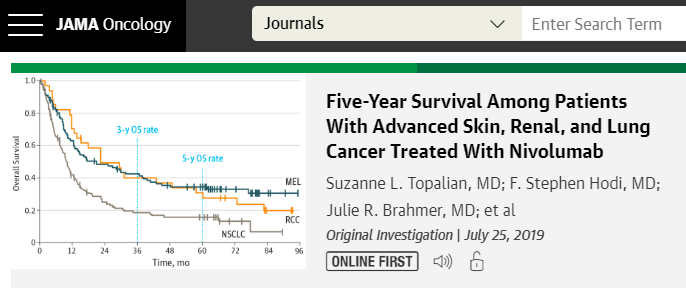
CANTOS研究是一個涉及近40個國家的10 061例心肌梗死後患者的多中心、隨機、雙盲、安慰劑對照的臨床試驗,所有患者雖接受普遍的他汀治療但仍殘存慢性炎症(hs-CRP2 mg/L),患者隨機分為3個劑量的卡納單抗治療組:分別為50、150和300 mg,每3個月皮下注射1次,主要觀察終點為非致死性心梗、非致死性卒中和心血管死亡。隨訪3.7年的結果顯示,與安慰劑組相比,僅150 mg卡納單抗治療組主要終點事件的下降差異有統計學意義(HR=0.85,P=0.021)。此外,與安慰劑組相比,僅300 mg卡納單抗治療組的所有癌症死亡率(HR=0.49, P=0.000 9)和肺癌死亡率(HR=0.23,P=0.000 2)顯著降低,而150 mg(HR=0.61, P=0.034)和300 mg(HR=0.33, P<0.000 1)兩個卡納單抗治療組的肺癌發生率顯著降低。CANTOS研究意義在於:(1)CANTOS研究第一次證明單純抗炎而非降脂治療可顯著減少冠心病患者的心血管事件,這使AS的"炎症假說"上升到"炎症理論";(2)如同4S試驗是AS降脂治療的裡程碑一樣,CANTOS研究成為AS抗炎治療的裡程碑,因此具有重大的歷史意義;(3)CANTOS研究第一次證明在AS人群中卡納單抗治療可同時降低冠心病事件和肺癌的發生率和死亡率,這可能是由於近1/4的入組患者仍在吸煙,而吸煙引起的慢性肺炎是肺癌的危險因素。這一結果提示,炎症是AS和肺癌的共同土壤,靶向IL-1β起到了"一石二鳥"的作用。儘管如此,CANTOS研究也引發了一些爭議:(1)試驗終點分析顯示,卡納單抗治療顯著降低了心肌梗死、需急症血運重建的不穩定性心絞痛和所有血運重建手術的發生率,但未降低卒中、心血管死亡和全因死亡率,這可能是由於分組較多使每組樣本量較小所致(CANTOS研究原計劃入組17 200例患者,後因經費限制而縮減);(2)與肺癌發生率和死亡率最大獲益發生在300 mg卡納單抗治療組的情況不同,心血管事件下降的最大獲益發生在150 mg卡納單抗治療組,這使我們懷疑卡納單抗的抗AS作用是否存在U形曲線;(3)與安慰劑組相比,卡納單抗治療顯著增加了偽膜性結腸炎、嚴重感染、敗血症、白細胞減低、血小板減低等不良反應的發生率,這顯然與免疫抑製有關;(4)目前單次卡納單抗輸注的費用約為1.6萬美元,這種高額的醫療費用將造成患者的極大負擔。基於近年的他汀臨床試驗數據,在他汀治療後LDL-C水準已達標的冠心病患者中,仍有40%以上的人群hs-CRP2 mg/L,具有卡納單抗治療的指征,但鑒於上述限制性,如何選擇抗炎治療獲益最大的人群是亟待解決的問題。晚近Ridker PM對於CANTOS研究的結果進行了二次分析,發現在卡納單抗治療後3個月hs-CRP<2 mg/L即抗炎療效較好的人群中,主要終點事件(HR=0.75, P<0.000 1)、心血管死亡率(HR=0.69, P=0.000 4)和全因死亡率下降(HR=0.69,P<0.000 1)31%,而在卡納單抗治療後3個月hs-CRP≥2 mg/L即抗炎療效較差的人群中,上述心血管事件率則無顯著下降,提示卡納單抗治療後3個月的hs-CRP水準可以作為篩選長期卡納單抗治療人群的簡便指標。
我國學者在AS炎症研究領域中的貢獻
在1999年Ross R提出AS炎症假說後不久,我國學者即開始了AS炎症機制和乾預靶點的研究。以"atherosclerosis, inflammation, China"作為關鍵詞檢索美國PubMed網站刊載的文獻,截至本文擬稿時,共有1 489篇,最早發表在國際雜誌上的AS炎症研究是2001年山東大學齊魯醫院周瑞海等發表的論文,他們發現急性心肌梗死和不穩定性心絞痛患者的血清IL-8和IL-12水準均高於正常人,但急性心肌梗死患者的血清IL-12水準高於不穩定性心絞痛患者。在AS炎症機制的研究方面,2004年,我們在國內首先建立了易損斑塊的兔模型,2009年建立了易損斑塊的小鼠模型,發現在這些模型中炎症是導致斑塊易損的必備條件和預測斑塊破裂的重要因子。2007年,我們發現,腫瘤壞死因子(TNF)-α作用於平滑肌細胞膠原合成酶的限速亞部門P4Hα(1)啟動子的反應元件,通過ASK1-JNK-NonO蛋白通路起到抑製P4Hα(1)的作用,從而抑製了斑塊的膠原合成。我們的研究還發現,炎症標誌物CRP可激活TNF-α轉化酶(TACE),使巨噬細胞表面的可溶性凝集素樣低密度脂蛋白受體1(sLOX1)脫落, sLOX1可損害血管內皮功能和促進炎症因子釋放。沉默TACE基因後可顯著下調斑塊內多種炎症因子的表達以及MMP-9和MMP-2的活性,增加TGF-β1的表達以及斑塊平滑肌細胞和膠原含量,其機制涉及ERK-NF-κB信號通路的下調和TGF-β1信號通路的上調。我們近年來研究發現,精氨酸酶1通過與誘導型一氧化氮合酶競爭L-精氨酸使轉錄因子NF-κB失活進而抑製脂多糖誘導的人主動脈平滑肌細胞TNFα的釋放,增加斑塊膠原的含量和斑塊的穩定性。過表達精氨酸酶1可降低斑塊內炎症因子的含量,增加IL-10的含量,提示精氨酸酶1具有抗炎作用。在AS的兔模型中,過表達精氨酸酶1增加斑塊的膠原和平滑肌含量,減少巨噬細胞和脂質的含量,從而穩定斑塊。
南京醫科大學徐湧團隊的研究發現,Brahma相關基因1(Brg1)和Brahma可促進促炎因子與黏附分子的相互作用,敲除Brg1/Brm基因具有抗AS作用。該團隊還發現,myocardin相關的轉錄因子(MRTF)-A在oxLDL誘導的血管內皮損傷過程中發揮關鍵作用,MRTF-A過表達可升高ICAM-1水準但抑製eNOS,而MRTF-A基因沉默則可減輕炎性反應。香港大學徐愛民團隊的研究發現,腸道Akkermansia muciniphila細菌能夠通過修復腸道黏膜屏障,減輕代謝性內毒素血症,減少斑塊中巨噬細胞的浸潤及炎性因子的表達,進而抑製AS的進展。北京生命科學研究院王曉東團隊的研究發現,介導壞死性凋亡過程的受體相互作用蛋白3(RIP3)可加重Aop E-/-小鼠的全身性炎症和過早死亡。北京大學王憲團隊的研究發現,MSun2通過促進ICAM-1的mRNA甲基化而上調ICAM-1的表達,這一發現對於了解AS過程中ICAM-1的調節機制具有重要意義。華中科技大學的程翔團隊的遺傳學研究發現,IL-33-ST2L通路與冠心病的發生可能有因果關係,這對於冠心病的防治提供了一個新的途徑。在AS炎症乾預的研究方面,由於血管緊張素Ⅱ(AngⅡ)是導致AS炎症的上遊因子,我們著眼於拮抗AngⅡ的RAS新成員的研究,在國際上首次將ACE2基因用於AS的實驗治療,證明ACE2過表達可抑製AS的早期病變,其主要機制是減輕了血管壁細胞的氧化應激和炎症反應。對於晚期斑塊病變,ACE2過表達可顯著減少斑塊內巨噬細胞和脂質含量,增加斑塊內平滑肌細胞和膠原纖維的含量,進而可穩定AS斑塊。Ang-(1~7)是ACE2的下遊小分子多肽,我們的研究發現,在早期AS病變的Apo E-/-小鼠,Ang-(1~7)通過抑製ERK/P38 and JAK/ STAT通路、增強SM22α和AT2受體表達而劑量依賴性地抑製病變進展,而在晚期AS斑塊的Apo E-/-小鼠,Ang-(1~7)抑製促炎因子的表達和MMPs的活性,劑量依賴性地增加成熟斑塊的膠原和平滑肌細胞的含量,降低斑塊內巨噬細胞和脂質的含量,從而增強了斑塊的穩定性。斑塊局部的AngⅡ主要通過肥大細胞分泌的糜酶所產生,而曲尼司特可抑製肥大細胞釋放糜酶。我們的研究發現,曲尼司特可有效地降低AS倉鼠斑塊局部的糜酶活性,抑製斑塊炎症反應,減輕斑塊脂質沉積,抑製斑塊纖維帽中膠原降解和平滑肌細胞凋亡,為糜酶作為AS抗炎靶點提供了實驗證據。我們還針對參與AS炎症的固有免疫和適應性免疫的細胞和因子進行了系列研究工作。我們將產生單核細胞趨化功能的MCP-1分子N端的第2~8位的氨基酸去除,造成MCP-1的缺失突變體(7ND)而保留與其受體CCR-2的結合功能,在體外試驗中證明7ND吸引單核細胞的作用顯著減弱,在兔易損斑塊模型的體內試驗中,證明在血清LDL-C顯著升高的情況下,7ND注射可顯著抑製局部和全身炎症,增厚斑塊纖維帽的厚度,降低斑塊易損指數,預防斑塊破裂,但對血脂水準無影響,從而提供了單純抗炎治療穩定斑塊的新途徑。為了證明TLR1、TLR2和TLR4受體在易損斑塊中的相對作用,我們應用單一或聯合干擾TLR1、TLR2和TLR4表達的方法,發現聯合干擾TLR1和TLR2基因對於穩定斑塊有相加作用但無協同作用,而TLR2和TLR4聯合干擾則有協同作用,表明對於穩定斑塊TLR2和TLR4聯合干擾優於單獨干擾,從而證明了基因治療中網路乾預的重要性。近年來,我們提出了在易損斑塊的治療中通過誘導免疫耐受而減輕斑塊炎症的新思路。結果顯示,在Apo E-/-小鼠易損斑塊模型中,Treg治療劑量依賴性地減少了斑塊破裂率,而聯合使用大劑量Treg和消除CD25細胞的PC61抗體治療,斑塊破裂率上升到對照水準。Tregs治療劑量依賴性地抑製斑塊炎症因子和MMP-2、MMP-9的釋放,增加P4Hα(1)的表達,顯著降低斑塊易損指數,這些療效主要由TGF-β和IL-10所介導。我們還發現,他汀治療不僅顯著增加了斑塊中Tregs的數量、Tregs標誌物Foxp3的表達以及TGF-β和IL-10的表達,而且可調節抗炎細胞(Tregs和Th2細胞)與促炎細胞(Th17和Th1細胞)之間的平衡。將來自急性冠狀動脈綜合征患者的周圍血單核細胞與他汀培養後,Tregs的相對數量和免疫抑製功能顯著增加。這些結果首次揭示了他汀增加斑塊中Tregs數量的治療新機制。此外,在易損斑塊的兔模型中,口服小劑量雷帕黴素可通過抑製巨噬細胞活性和炎症因子,顯著抑製局部和全身的炎症反應,顯著抑製斑塊進展和降低斑塊易損指數,降低了斑塊破裂率。與大劑量辛伐他汀相比,雷帕黴素不影響血清LDL-C水準但更顯著地減低斑塊負荷,因而兩者穩定斑塊的作用無差異。早在2004年,中南大學趙水準團隊就發現,中藥血脂康治療可顯著改善超聲技術測量的冠心病患者血管內皮功能,這一作用的機制是降低餐後血脂和hs-CRP水準。瀋陽軍區總醫院韓雅玲團隊的研究發現,CREG作為溶酶體調控分子,可促進巨噬細胞溶酶體的發生及溶酶體自噬功能,抑製巨噬細胞炎症反應,抑製AS斑塊形成。該團隊還發現,AngⅡ誘導Ets-1激活而抑製CREG基因轉錄是高血壓血管纖維化發生的重要機制之一,過表達CREG蛋白則可對抗AngⅡ誘導的血管重構,從而為AS的抗炎治療提供了一個新的靶點。
AS抗炎治療的前景
雖然CANTOS研究取得了令人鼓舞的成果,但IL-1β並非一個理想的抗炎靶點,一是因為IL-1β位於AS炎症反應信號通路的上遊,是一個負責機體炎症和免疫反應的"指揮部",因此卡納單抗治療在取得AS抗炎療效的同時也產生了多種損害免疫反應的不良反應;二是因為卡納單抗的量效關係不明,因此造成了300 mg劑量組的AS抗炎療效反而低於150 mg劑量組的結果;三是因為在AS漫長的病程中,有眾多的炎症信號通路被激活,隻對抗單一的炎症因子是不夠的。因此,尋找更為理想的靶點是今後AS抗炎治療的重要任務。
在AS抗炎治療的臨床研究領域中,2013年發表的LoDoCo(low-dose colchicine)隨機臨床試驗顯示,小劑量秋水仙鹼可減少穩定性冠心病患者的心血管複合終點,但這一試驗的樣本量較小(532例),為開放標籤的非雙盲設計,故說服力有限。目前,一個更大樣本量的秋水仙鹼臨床試驗(colchicine cardiovascular outcomes trial,COLCOT)正在進行中。此外,Ridker PM長官的由美國國家心肺血液研究所資助的CIRT研究將探索低劑量甲氨蝶呤對心肌梗死後患者心血管複合終點的影響,這一藥物的抗炎靶點仍是IL-1β,結果即將揭曉。
在AS抗炎治療的基礎研究領域中,多個動物模型中驗證的乾預靶點正在走向藥物研發。我們所驗證的有效靶點ACE2是一個805個氨基酸組成的蛋白,長期使用可能有免疫反應。近年來,我們已找到ACE2基因轉錄的啟動子,這為ACE2的新葯研發奠定了基礎。Ang-(1~7)是一個僅有7個氨基酸組成的小分子多肽,但體內半衰期較短,目前已有藥廠開始研發Ang-(1~7)的新葯。針對IL-1α的人源性抗體MABp1亦有抗炎作用,目前已進入Ⅰ期臨床試驗。由於MCP-1在AS的發生和發展中起到關鍵作用,針對MCP-1受體CCR-2的單克隆抗體已進入臨床試驗。我們相信,CANTOS研究的成功,將極大地加速上述乾預靶點邁向臨床應用的前進步伐。
"寶劍鋒從磨礪出,梅花香自苦寒來"。人類攻克AS堡壘的鬥爭已持續了170年,經過長期艱苦卓絕的努力,終於取得了調脂治療和抗炎治療兩大戰役的勝利,但動脈粥樣硬化性心血管病仍是人類的第一殺手,AS的防治仍是任重而道遠,正如1942年丘吉爾所說:現在還不是終點,甚至不是一個終點的起始,但或許是一個起始的終點。