二代測序(NGS)又稱大規模平行測序,能夠同時對上百萬甚至數十億個DNA分子進行測序,實現了大規模、高通量測序的目標,是繼Sanger測序之後的革命性進步。目前在臨床腫瘤實踐中,NGS主要應用於驅動基因測序,是腫瘤精準診療的重要環節。中國臨床腫瘤學會於2015年9月17日在廈門市召集了我國具有代表性的腫瘤學專家、病理及分子生物學專家及NGS技術專家,成立了中國腫瘤驅動基因分析聯盟(CAGC)並啟動了精準腫瘤學研究項目(CAGC-POI),確立了整體項目的組織框架和內容框架。CAGC-POI計劃第一階段擬在初步建立NGS技術臨床應用共識的基礎上,在肺癌、乳腺癌、肝癌、胃癌、結直腸癌、造血系統腫瘤等惡性疾病開展以NGS技術為主的驅動基因譜分析。在上述共識建立、主要6個瘤種的變異譜分析驗證、優化流程的基礎上,將在攜帶有臨床可靶向作用驅動基因的患者中,開展相應的靶向精準診治的實踐與試驗研究。最終提出適合我國臨床腫瘤學實踐的NGS技術標準和規範,提高為腫瘤患者服務的品質和能力。
NGS有明顯的通量優勢及發現未知基因變異的優勢,但是在使用中也存在包括檢測技術、數據管理、分析與報告、解讀與臨床顧問等方面的各種挑戰。在我國基因檢測已經成為臨床精準診治的前提,但缺乏統一的關於NGS的應用共識。在未來,腫瘤臨床實踐中甚至可能需針對外顯子組、轉錄組、全基因組、表觀遺傳組的資訊分析和應用。可以預見的是,NGS高通量技術將會在檢測技術、分析內容、解讀等方面一直產生變化,也會帶來在實踐應用中的各種挑戰。
2017年,在美國來自商業公司與學術機構的醫學NGS服務得到美國食品藥品監督管理局(FDA)的認可,提示NGS已正式進入臨床實踐應用,同時對NGS各種醫學服務的審核進度在加快。
在我國現階段,腫瘤患者數目龐大,驅動基因診斷和檢測應用需求巨大。但在實際應用中會因為檢測技術的準入門檻低、缺乏臨床公認的NGS指導規範,腫瘤診治中可能存在檢測品質低下、結果準確性差,檢測結果解讀不專業,甚至盲目追求基因檢測結果的現象。因此,我國腫瘤學界亟需對當前NGS在臨床合理規範的使用進行充分討論,形成共識予以發布,以指導我國臨床腫瘤診療中的規範應用。
本技術共識闡述了NGS技術品質需求、臨床腫瘤相關NGS檢測內容、樣本處理、測序流程、數據管理、資訊學分析、結果報告解釋和顧問等多個方面的內容。本共識也對患者知情同意、測試項目的質控、研究與診斷的應用差別等內容進行了說明。文中的"聲明"是專家組討論的各個要點,也即專家組形成的共識或推薦。
NGS在臨床腫瘤診斷中的品質需求
NGS技術正處於不斷的發展和完善過程中,需對NGS技術現狀有正確的認識。在過去十年腫瘤學界的研究和應用顯示:在恰當的技術條件下,NGS確實能夠高通量地檢測分析腫瘤中的驅動基因變異或治療性靶點,給部分患者帶來治療和生存的獲益。
在臨床實踐中各實驗室可能有不同的NGS技術平台。無論使用何種平台,各實驗室均應按照本共識中的推薦(聲明)開展NGS項目測試,對平台及相關分析工具進行驗證後才應用於臨床。
針對腫瘤的多基因檢測,需設計特定的NGS測試項目。這些項目的檢測結果應能夠明確回答臨床診療所需的基因狀態。需明確指出的是,應避免分析技術能力尚未得到充分驗證的NGS項目在臨床應用。
聲明1:臨床腫瘤診斷應用的NGS項目應符合相應的診斷技術標準
未進行充分分析和臨床驗證的NGS技術不應在臨床實踐的驅動基因診斷中應用。相關實驗室應明確能夠提供的檢測項目的內容範圍和相關技術參數。
NGS用於臨床腫瘤分子診斷能夠帶來明確的益處。NGS技術優勢:一次性、特定時間(約10個工作日)產生覆蓋基因組特定區域(從數個基因到數百個基因以至外顯子組、轉錄組或全基因組)的通量數據,同步獲得多基因、多位點、多種變異形式的分子檢測結果。儘管目前NGS的多基因多重分析總成本較高,但相對於傳統檢測方法而言,單個基因單個位點的檢測費用已大大下降。
影響NGS結果的限制性因素包括:平台類別、靶區域富集方法、文庫構建及擴增效率、測序數據量、生物資訊學分析流程等。在臨床應用之前,對於特定突變位點的NGS檢測結果在低品質數據條件下應採用其他方法進行結果驗證。檢測實驗室的專家、腫瘤患者的主診醫師與患者應就開展腫瘤NGS分析的利弊進行充分溝通和知情同意,同時讓臨床醫師了解特定NGS測試項目的醫學意義。
聲明2:NGS檢測項目的目的和臨床益處應明確
如果是用於臨床靶點抑製劑(靶向藥物)的使用決策參考,檢測結果應能夠明確一些在臨床可採取特定藥物靶向治療的靶點變異資訊。NGS測試項目如果是用於分子分型、療效預測或預後判斷則需在發現集的基礎上建立分析模型,再通過技術和驗證集的驗證方可進一步轉化應用於臨床。
NGS在臨床腫瘤應用的檢測內容
在臨床實踐中,不同的瘤種既可存在瘤種特異性的驅動基因變異,也可能存在共同的基因變異。一個瘤種存在眾多的分子變異亞型,從而提出"同病異治"或"分型而治"的策略;不同瘤種之間由於存在共同的驅動基因分型,則可以採取"異病同治"的策略。由此可見,臨床腫瘤的基於基因或基因組學的分子分型將逐步超越傳統的病理組織形態學分型,成為臨床診治腫瘤的關鍵環節。
腫瘤的多基因分型對藥物研發策略也產生了重大影響。在藥物臨床試驗設計方面,近年來出現了兩種基於分子靶點的試驗研究設計類型。一種是"雨傘"設計類型,即針對單個瘤種的基於多個驅動基因分型及其靶向治療,另一種則是"籃子"設計類型,是針對多個瘤種的驅動基因的同型同治。
無論是臨床實踐還是臨床試驗,用於基因分型的NGS檢測項目內容均需精細的設計和技術可靠性的驗證。NGS項目的檢測內容應明確檢測哪些基因、相應基因的受檢區域、靶點的變異資訊等。
聲明3:如果NGS用於臨床分子診斷,應明確至少哪些基因需納入檢測名單中
這個必須的"核心基因清單"需特定腫瘤亞專科相關的臨床和實驗室多學科專家共同討論後制定。
核心基因清單論證及制定過程中應以患者的利益為中心,充分整合臨床腫瘤學家對於精準診治的觀點,並充分考慮在我國推廣應用的可操作性。以肺癌為例:目前美國國家綜合癌症網路(NCCN)及國內肺癌臨床指南、共識或衛計委診療規範都明確指出表皮生長因子受體(EGFR)基因突變、鼠類肉瘤病毒癌基因(KRAS)突變、間變性淋巴瘤激酶(ALK)基因重排(融合)、c-ros肉瘤致癌因子-受體酪氨酸激酶(ROS1)基因重排(融合)、間質上皮轉移因子(MET) 基因14號外顯子可變剪切變異、MET拷貝數擴增、轉染重排(RET)基因重排(融合)、人類表皮生長因子受體2(HER2)基因突變或擴增、鼠類肉瘤濾過性毒菌致癌同源體B1(BRAF)基因突變等驅動基因變異是臨床實踐中的重要必須基因。
從CAGC-POI項目的惡性腫瘤的整體角度考慮,檢測內容(基因組合及其基因組區域)應既包括各瘤種特異性的組合,也應備有一個大而全的基因組合。因實體瘤和血液腫瘤的變異譜方面的差異較大,因此,在大而全的組合中對實體瘤和血液腫瘤應分別設計。
可靶向作用的原理及定義:驅動基因的定義是參與腫瘤發生髮展、轉移、耐葯等疾病進程中關鍵步驟的基因。可靶向作用則是指針對該驅動基因的變異靶點或其上下遊關鍵分子,能夠採用靶向藥物等手段進行治療,從而達到抑製腫瘤進展或消退腫瘤的治療效果。可靶向作用基因也可指該基因的變異可以用來作為明確的分子亞型診斷或預後判斷。
聲明4:可靶向作用基因的變異可能會影響臨床決策,醫師需根據基因分型的檢測結果來指導臨床診療方案
可靶向作用基因的變異可分為兩大類,第一類包括國際、國內指南[中國臨床腫瘤協會(CSCO)、美國臨床腫瘤學會(ASCO)、NCCN、歐洲醫學腫瘤學會(ESMO)等]中明確指定的、藥物標籤中說明的、與FDA及我國國家食品藥品監督管理總局(CFDA)批準的適應證相關的臨床分型基因變異,或是具有明確的分子診斷或預後判斷價值的基因變異。第二類包括正在開展的任何期別(Ⅰ~Ⅲ期)臨床試驗中的藥物相關靶點、在已經或即將開展的臨床試驗中作為入組條件的變異靶點、在國內外指南中其他腫瘤或疾病適應證的藥物靶點、用於輔助診斷或預後判斷的靶點等。
在NGS檢測中,對於臨床意義非常明確的體細胞突變的少數基因集分析,可以直接檢測腫瘤標本而無須設定白細胞等對照樣本。但對於需包含上述第二類可靶向作用基因的更大的基因集分析,尤其是數百基因乃至全外顯子組測序等,建議在腫瘤樣本進行NGS檢測時設定患者自身白細胞樣本對照分析。
聲明5:應根據實際情況需對檢測內容進行更新
隨著腫瘤發生髮展機制研究的不斷深入,新的靶點及藥物會得到不斷的發現和研發。因此,有必要定期或不定期依據重要的臨床研究進展對檢測內容進行討論並發布更新。
聲明6:應對每個基因變異位點進行明確定義注釋
檢測基因數量越多,診斷資訊會越多。但由於腫瘤信號通路的冗餘性和複雜性,在基因清單中,除了核心基因之外,應對其他增加的每個基因進行明確定義注釋,說明其基因型與潛在可靶向作用位點或通路的關係。在實際的NGS測試項目應用中,檢測基因數量的增加不應以核心基因的檢測品質受損為代價。
技術參數驗證對保證檢測結果的準確性很重要。所有NGS計量參數都應明確說明。在檢測中應記錄批次或分析樣本特異性的特徵。檢測實驗室應利用結構化的資料庫來保證平台、各分析項目、樣本處理等方面的品質分析。在檢測分析流程中,每個樣本都應做好唯一性標識。在平台穩定性驗證中,應使得所有儀器和試劑都符合標準要求,提供特定驅動基因的準確性和精確性。
技術驗證過程中應記錄在案的相關內容或參數包括以下幾方面:(1)樣本相關的患者資訊保護原則、唯一性標識、接收、存儲、處理各步驟內容及時間;(2)實驗操作過程中DNA/RNA處理每一步驟所用試劑名稱、生產廠家、批號,記錄每一步操作後的品質指標(如RNA的完整性數值等);(3)數據分析及資料庫管理相關的軟體(包括版本號,分析時所用各項參數)、數據的相關參數(數據量大小,查詢緩存等)、資料庫的安全性和備份情況等。
聲明7:NGS項目的檢測流程和生物資訊學分析需針對特定平台和分析項目進行充分優化和標準化
流程驗證中應提供分析敏感性和特異性的參數。因為分析方法的差異,針對單鹼基位點變異(SNV)、插入或缺失(INDEL)、重排(融合)、拷貝數變異(CNV)等不同的變異應分別測試技術的敏感度和特異度。受樣本取材或探針設計等因素影響或限制,NGS在某些變異類型如拷貝數擴增的檢測方面有時存在一定的局限性。對於NGS方法準確性可能有影響的情況,應考慮採用可靠的單基因方法對檢出變異進行驗證。
NGS應用中的樣本處理
NGS檢測需文庫構建,該步驟原始材料為DNA或來自RNA的cDNA。適合臨床NGS分析的樣本類型優先選擇新鮮組織標本,也可選用甲醛固定-石蠟包埋(FFPE)樣本、腫瘤細胞學標本及血漿(遊離DNA/RNA)等。
NGS可用於疾病初診時的分子靶點分析,也可用於治療中疾病進展狀態的監測及耐葯分子機制的診斷。因而在疾病的全程管理中可合理地考慮在診療的關鍵時間節點收集臨床標本進行NGS分析。決定是否採用NGS在多個時間節點的檢測分析應做好多學科討論和充分的知情同意。
各類樣本採集:(1)對於手術和活檢的新鮮組織:理想的保存方法是迅速置於液氮中,可保存於液氮罐或-80 ℃冰箱,該過程應在手術離體後30 min內完成,以防止RNA等核酸降解;或採用保存在樣本保護劑中,儘早轉移到-80 ℃冰箱保存。可採用冷凍切片染色評估樣本中的腫瘤細胞含量。(2)FFPE:按病理操作規範進行取材。手術或活檢離體的組織應在30 min內浸入100 ml的4%甲醛溶液中進行固定,避免使用酸性及含有重金屬離子的固定液。大標本應切開後充分固定至6~48 h,不超過72 h。小活檢標本可固定6~12 h。開展NGS檢測前應進行HE染色評估腫瘤細胞的含量。(3)細胞學樣本:脫落細胞學標本及細針穿刺細胞學標本用於基因檢測時,必須進行病理質控,確定標本中的腫瘤細胞數量及與正常細胞的比例,符合品質要求或通過腫瘤細胞富集處理後符合要求的標本可直接抽提核酸,也可以製備成FFPE細胞學蠟塊進行後續分析。體腔積液標本可提取無細胞上清標本中的循環腫瘤DNA(ctDNA)進行檢測。(4)血漿或血液樣本:ctDNA是存在於血漿中的遊離DNA,腫瘤來源的DNA佔血漿遊離DNA的比例在不同腫瘤及病例中相差懸殊。採集外周血提取血漿遊離DNA進行檢測,取樣時應使用一次性的含乙二胺四乙酸(EDTA)的抗凝真空采血管,採集8~10 ml全血,冷藏運輸,2 h內分離血漿,提取遊離DNA,保存於-80 ℃冰箱中,並避免反覆凍融。如外周血需長時間運輸,建議用商品化的遊離DNA樣本專用保存管,在常溫條件下,ctDNA在全血中可穩定保存3~7 d。由於血細胞基因組DNA的潛在大量釋放會極大地稀釋血漿遊離腫瘤DNA的濃度,經肉眼觀察確認為溶血的樣本不適用於對遊離腫瘤DNA的NGS檢測。當懷疑血漿遊離DNA受到血細胞基因組DNA汙染時,可考慮採用核酸片段大小分布分析來判斷汙染是否存在,而從判斷樣本是否適用於NGS檢測。
採樣品質的評價對後續結果的解讀有重要意義,臨床樣本的採樣過程、分析前的運輸和處理流程以及病理的評估結果等均應做相應的記錄。品質評價的內容應包括腫瘤細胞含量比例、腫瘤細胞的數量,是否按照要求進行處理與運輸等。評價方法包括肉眼觀察、顯微鏡下觀察和血漿樣本核酸濃度分析等。對於腫瘤細胞分布集中的區域應進行標註,必要時進行顯微切割後再提取核酸。
樣本採集和處理中的防汙染:樣本採集最好採用一次性材料;製備不同患者病理切片樣本時,需更換新刀片,並清除操作器皿或切片機上先前樣本的殘留。
樣本運送和保存:實驗室應建立詳細的樣本運送標準操作規程(SOP),對臨床醫師提供樣本採集手冊,要求物流人員填寫相關運送記錄表,確保運送過程中各類樣本的安全性和過程的可控性。石蠟材料可常溫運輸,血漿樣本乾冰條件下運輸,核酸樣本需在4 ℃或冷凍條件下運輸。
聲明8:為提高NGS檢測腫瘤驅動基因的準確性,應提供高品質的臨床生物材料樣本
不同類型生物材料的收集及處理均應有明確的SOP指導。
聲明9:樣本登記過程中每個標本應在NGS分析中有唯一性標識
包括來自同一患者的不同組織病灶、不同組織切片、不同核酸樣本等均有唯一性的標識。
聲明10:應有充分的樣本評估和起始核酸用量
除了血漿或血液來源的DNA/RNA,凡是涉及形態學的標本,應在顯微鏡下評估腫瘤細胞的含量,充分記錄各類形態學惡性細胞的含量比例。評估記錄還應包括標本收集和處理方法。腫瘤細胞比例低的標本必要時應採用包括顯微微切割在內的有效富集腫瘤細胞的方法,提高腫瘤細胞比例。一般情況下,適合於NGS檢測的組織標本中腫瘤細胞含量建議應達到20%以上。如果腫瘤細胞佔比較低,患者知情後依然願意進行NGS檢測,應盡量採用顯微切割技術富集腫瘤細胞,或增加NGS測序數據量以提高測序覆蓋深度,並在報告中提示樣本局限性。組織樣本抽提獲得的DNA量應達50 ng以上用於NGS檢測。血液樣本建議采血至少8 ml,分離血漿遊離DNA用於NGS檢測。
聲明11:應對抽提後和文庫構建後的核酸樣本進行質控
組織DNA與血漿遊離DNA等核酸樣本均應進行檢測前的品質控制分析,包括核酸的濃度和純度分析。組織DNA樣本應進行核酸完整性分析,以判斷DNA品質。血漿遊離DNA樣本應進行片段長度分布分析,以判斷是否存在血細胞基因組DNA的汙染。在文庫構建後應對核酸樣本進行濃度測定與文庫片段分布等品質控制。
聲明12:應預留生物材料用於後續驗證
為了便於後續採用其他技術方法對檢測結果進行驗證,在樣本留取時,應適當考慮增加生物材料的留取量。在石蠟標本的切片過程中可考慮適當同步預留幾張切片用於後續免疫組化、熒光原位雜交、聚合酶鏈鎖反應(PCR)測序等方法驗證。
NGS測序技術及流程
在臨床腫瘤診斷和監測中的NGS應用應充分關注試劑管理、樣本的質控/品質保證、檢測環境、人員資質和熟練程度、NGS技術參數標準(包括文庫構建、測序流程、質控等)等環節,以SOP加以約束,以保證特定腫瘤NGS測試能夠穩定準確地發揮作用。
測序技術的各個環節應做好實驗室規範記錄,最好有結構化的資料庫進行管理,包括平台環境參數、試劑使用和性能、樣本追蹤、質控數據等管理。通過日常和定期分析質控保證檢測的準確性。
為滿足臨床需求,實驗室需對各個品質控制步驟出現異常、失敗的樣本規定合理的備選方案。比如採用其他分子診斷平台檢測一部分重要位點,或對陽性位點採用其他平台確認性檢測,或者重複高通量測序流程等,有條件的檢測部門也可以重新選取標本。
聲明13:NGS檢測需符合嚴格的檢測環境要求
各類樣本的儲存、核酸抽提處理及NGS分析應在通過審核驗收的臨床基因擴增檢驗實驗室完成。
聲明14:應對NGS試劑進行嚴格的管理和質控
NGS試劑應獨立存放,防止交叉汙染。對於實驗室自配試劑或探針及採購試劑,均需做好每批試劑的性能評價,評價合格後才可用於臨床樣本分析。
聲明15:每個特定NGS測試項目均需經過嚴格技術驗證合格後才可用於臨床腫瘤檢測
診斷測試項目必須在準確性、分析敏感度、特異度、精確性等方面進行充分評價。如果檢測項目中的試劑或步驟有任何主要變更,則品質參數需重新評價。在針對檢測項目更新或更新的重新評價中,應明確測試所需的樣本類型及例數。強烈建議各實驗室參加NGS相關的室間品質評估項目來評測檢測能力和品質。
聲明16:應制定有明確的檢測流程
這個檢測流程包括樣本質控/品質保證、樣本預處理、接頭連接、預擴增、基因組合靶區的捕獲、靶區純化、擴增文庫構建、質控定量後上NGS測序儀檢測等步驟。每個步驟的操作和品質控制都應建立SOP進行指導。如果使用擴增子建庫的方式,同樣需建立相應的SOP進行質控管理。
聲明17:NGS技術檢測項目應達到標準化
遵照相關技術規範,使得上述樣本預處理至文庫構建、測序、質控的技術標準化,也包括原始數據產生和管理、資訊學分析過程的標準化。由此CAGC將在下一階段可行性驗證基礎上形成一套NGS技術SOP。
聲明18:人員配備和熟練程度應滿足實踐需求
應配有專門的質控人員。對於參與NGS實驗流程操作的技術人員進行充分的培訓,達到一定的熟練程度。每個平台應有技術員專職從事實驗操作。
聲明19:需使用核心基因清單與相應的檢測標準品用於各個實驗室間的質控比較
根據檢測驅動基因的突變結果描述、目的區域的覆蓋度等建立評分體系。這個評分體系將用於對實驗室間NGS檢測能力的分析與認證。
NGS數據的產生、管理、資訊學分析
由於NGS數據龐大,數據管理、儲存和分析需強大的計算平台支持。數據的品質檢查、資訊學分析、輸出格式、儲存等方面都應有SOP支持。最好有結構化的資料庫來管理原始數據、質控數據以及分析結果數據等。
聲明20:應對所採用的數據分析工具(軟體)進行能力驗證
需採用適量例數的原始數據針對NGS數據分析工具進行驗證分析。通過採用攜帶不同種類與豐度變異的數據來驗證整個分析流程的準確性與穩定性。特別是在增加檢測基因的內容時需驗證分析工具的可靠性。分析工具的能力驗證應有詳細的內部軟體驗證記錄。CSCO、CAGC也將組織開展軟體分析能力驗證。
聲明21:檢測實驗室應規範數據產生和管理儲存流程
檢測實驗室必須採用結構化的資料庫來注釋單鹼基位點變異、插入或缺失、重排(融合)、拷貝數變異等各類變異資訊。
聲明22:數據儲存應採用通用的FASTQ、BAM、VCF格式,便於數據交換及實驗室間評價
同時保存完整的日誌檔案,便於區別流程版本資訊、追溯異常結果來源及分析原始數據向診斷報告生成的可重複性。診斷實驗室應長期保存相關的數據集(至少15年)。
聲明23:NGS原始數據的品質檢查,應有嚴格的操作規程指導
所有參數需與檢測性能評價過程中的參數進行比較,設定並執行接受與拒絕的標準(表1)。
表1 FASTQ和BAM品質的計量參數
註:橫屏或網頁版觀看效果更佳
| 參數 | 描述 | |
| ·每循環的中位鹼基品質 | ·在序列片段末端鹼基測序品質會急劇降低。Phred序列品質評分不能<20 | |
| ·重複片段佔比 | ·重複測序片段佔比是反映文庫構建的複雜度的指標 | |
| ·去除接頭序列鹼基的佔比(如果適用) | ·在去除接頭序列時,去除的鹼基所佔比例是反映序列品質的指標 | |
| ·比對成功的片段佔比 | ·能夠比對到參考基因組序列上面的測序片段的比例 | |
| ·目標區域片段佔比 | ·能夠比對到富集目標基因組區域的片段在所有測序片段中所佔的比例 | |
| ·目標區域的平均測序深度 | ·符合臨床需求的目標檢測區域中所有位點的平均測序深度 | |
| ·目標區域測序深度的分布 | ·在符合臨床需求的目標區域所覆蓋的所有位點中,繪製測序深度分布圖或不同測序深度覆蓋位點的佔比表格 | |
| BAM計量參數 | ||
| ·總變異數量 | ·符合臨床需求的目標區域中檢出的總變異數目應當與同類患者群體且採用相同捕獲區域以及處理方法相同的樣本結果相類似 | |
註:FASTQ:一種存儲了生物序列(通常是核酸序列)以及相應品質評價的文本格式;BAM:序列比對之後常用的輸出格式
聲明24:不同瘤種的NGS數據分析應遵循相同的基本流程
分析流程包括初步分析、接頭序列去除、引物序列去除、低品質序列去除、參照基因組序列比對、去重、插入或缺失重複比對、鹼基品質得分校正、突變識別、注釋、過濾後輸出等步驟(表2)。CAGC-POI項目需在各個瘤種中的每一步都應做到同質性。
表2 臨床腫瘤NGS技術的簡單流程步驟描述
註:橫屏或網頁版觀看效果更佳
| ·去除引物序列 | ·擴增子測序的引物序列必須從測序片段中去除 | ·CutAdapt,BWA | ·FASTQ或BAM |
| ·去除接頭序列(可選項) | ·將測序接頭序列從測序片段末端去除。若不能去除,測序接頭可能會干擾序列比對和變異檢測,從而導致假陽性或假陰性突變 | ·CutAdapt,BWA,Trimmomatic,SeqPrep | ·FASTQ或BAM |
| ·去除低品質鹼基(可選項) | ·低品質的鹼基也可能干擾序列比對和變異檢測,可將其從測序片段末端(或前端)去除 | ·CutAdapt,BWA,Trimmomatic,SeqPrep | ·FASTQ或BAM |
| ·序列比對 | ·在序列片段比對階段,雙端/單端序列片段都被比對到參考基因組上,單鹼基改變和插入缺失變異都會在這個過程中被識別出來 | ·BWA,Novalign,Stampy,SOAP2,LifeScope,Bowtie | ·BAM |
·去重(可選項)
·在文庫構建和測序過程中,PCR擴增會導致重複測序,不可信的重複會降低判讀準確性,因而重複序列應被去除。探針雜交捕獲測序結果中重複片段較少,這是因為DNA是被隨機打斷建庫的。擴增子測序若無片段標籤,不需去重複,若有片段標籤,則需去重複
·Picard Mark Duplicates
·BAM
·插入缺失再比對(可選項)
·測序樣本中INDEL周圍可能出現一些單鹼基測序錯配誤差,特別是容易發生在測序片段開頭或末端,因而造成假陽性突變判讀。局部重新比對法可確定這些位置且通過局部重新比對來盡量減少這種錯誤,增加準確性
·GATK,SRMA
·BAM
| ·校正品質評分(可選項) | ·與參考基因組比對之後,片段中鹼基品質評分可被重校準以減少錯誤的突變判讀 | ·GATK,ReQON | ·BAM |
| ·變異判讀 | ·變異判讀是指依據測序數據與參考基因組之間差異來檢出和描述變異(包括單鹼基改變和短的鹼基序列插入或缺失) | ·GATK, SAMtools和Platypus | ·VCF |
·注釋
·對變異的解讀依託於詳細的注釋。最基礎的注釋有基因名、區域(外顯子、拚接區域、內含子、基因間區域等)和解碼改變資訊。此外,可利用已知基因多態性等位基因頻率、致病性及其他資料庫資訊進行注釋
·Annovar,SNPeff,Cartagenia Bench Lab NGS,dbSNP,1 000 Genomes,ESP 6500,SIFT,PhyloP,MutationTaster,COSMIC,OMIM,ClinVar,HGMD
·CSV,TSV,TXT,Excel
·篩選
·從大量變異列表裡尋找與鑒別疾病相關變異須經過嚴格篩選。典型變異篩選要排除低品質變異、非編碼區(如內含子或基因間區域的變異)、同義SNVs及已知健康人群中低頻的基因多態性。實驗室應建立內部資料庫,分析在自己平台上經常出現的假陽性變異,針對其進行嚴格篩選去除
·Cartagenia Bench Lab NGS,SnpSift
註:NGS:二代測序;FASTQ:一種存儲了生物序列(通常是核酸序列)以及相應品質評價的文本格式;CutAdapt:剪輯序列軟體;BWA:比對序列軟體;BAM:序列比對之後常用的輸出格式;Trimmomatic:數據讀取過濾工具;SeqPrep:合併雙端序列的工具;Novalign:序列對比工具;Stampy:序列對比工具;SOAP2:用於短寡核苷酸比對的軟體;LifeScope:數據分析工具;Bowtie:超快速、高效讀取器;PCR:聚合酶鏈反應;Picard Mark Duplicates:處理高通量測序數據和格式並標記重複的命令行工具;GATK:基於多重序列(重新)對齊改進讀取的工具;SRMA:短讀取並進行調整的工具;ReQON:校正工具;SAMtools:讀/寫/編輯/索引/查看SAM / BAM / CRAM格式的工具;Platypus:高通量測序數據中高效準確的變異檢測工具;VCF:通常為GATK和SAMtools軟體處理所得到的檔案格式;Annovar:利用更新的最新資訊對從不同基因組中檢測到的基因變異進行功能注釋的工具;SNPeff:基因組變異注釋和功能效果預測工具;Cartagenia Bench Lab NGS:用於NGS自動變體評估方案和實驗室報告生成;dbSNP:單核苷酸多態性資料庫;1 000 Genomes:迄今為止最詳細的人類遺傳變異目錄;ESP 6500:包含6 500個外顯子組的外顯子組測序項目;SIFT:變異預測工具;Phylop:測量個別校準點的進化保存;MutationTaster:評估DNA序列變體的致病潛力的工具;COSMIC:收集和顯示癌症體細胞突變的資訊資料庫;OMIM:關於人類基因和遺傳紊亂的資料庫;ClinVar:由國立生物技術資訊中心(NCBI)主辦和國立衛生研究院(NIH)資助的人類變異與表型關係報告的公共檔案;HGMD:人類基因變異資料庫;CSV:逗號分隔值,其檔案以純文本形式存儲表格數據(數字和文本);TSV:製表符分隔值,是一種用於儲存數據的文本格式檔案,其數據以表格結構(例如資料庫或電子表格數據)儲存;TXT:是微軟在作業系統上附帶的一種文本格式,是最常見的一種檔案格式;SNVs:單鹼基位點變異;SnpSift:使用資料庫、過濾器和操縱基因組注釋的變數以注釋基因組變數的工具
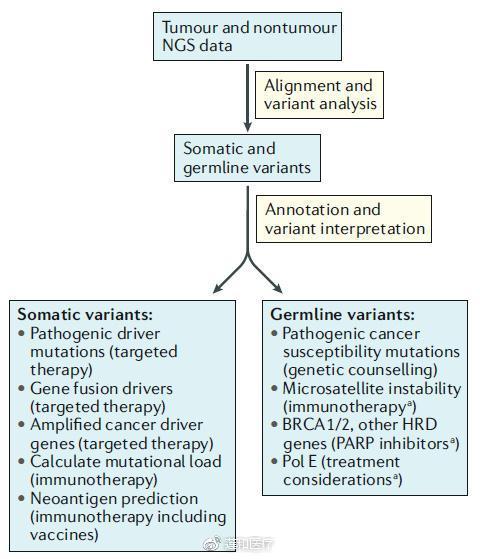
聲明25:體細胞與胚系來源的變異應加以區分
體細胞突變在腫瘤診療中的臨床意義較大。特定的胚系突變的生物學意義需說明,如乳腺癌中BRCA1/2的相關胚系來源突變。
聲明26:應對各個瘤種中具有明確或重要臨床意義的基因變異進行關注分析和說明
比如肺癌中的EGFR exons 18-21基因突變、ALK基因重排、ROS基因重排、MET E14基因拚接變異、HER2基因插入突變或擴增等突變的說明。
近年來,關於腫瘤細胞分子異質性的研究進展發現,腫瘤中存在不同分子變異亞型的亞克隆。異質性亞克隆的存在會影響腫瘤疾病的整體進化路徑及對靶向治療的應答和耐葯。因此NGS用於腫瘤診斷或耐葯監測時需達到較深的測序覆蓋度,這樣才能充分解釋腫瘤轉移進化過程中的異質性及其與臨床表型的關係。
聲明27:CAGC建議,臨床腫瘤組織樣本的NGS檢測數據中測序有效深度應達到500倍以上,測序深度是指測序得到的鹼基總量與基因組大小的比值,是評價測序量的指標之一;血漿遊離DNA標本的NGS有效測序深度應達到1 000倍以上
說明:(1)有效深度定義為去除PCR重複讀取(複製)之後的深度;(2)應在80%以上的目標捕獲區域達到這個深度,而非是所有區域的平均,否則在區域間覆蓋波動較大的情況下會有大量區域出現覆蓋不夠的情況。
聲明28:CAGC項目數據的管理應在標準流程和各類數據管理方面實現同一化
在後續將開展每個瘤種約100例的分析,從而對本次共識的可操作性進行驗證。
NGS結果報告與顧問
NGS是多步驟的複雜的檢測和分析方法,產生報告的內容較多。對臨床而言需遵循首頁簡明、結果明確、解釋清楚、資訊充分的原則。
在開展NGS臨床測試之前,應明確定義所檢測的驅動基因在基因組上的哪些靶區域範圍,並在報告中告知臨床醫師。
NGS報告結果應簡明清晰。具有臨床靶向意義的檢測結果及其參數應優先報告,如EGFR L858R突變,突變位點佔比(MAF)=15.6%。在報告首頁中應包括患者身份標識號、臨床診斷、測試的簡單描述、技術類型等資訊。根據情況,報告可以適當添加附件成多頁。各個瘤種的核心基因檢測結果必須明確報告,其他基因根據結果概括性報告,對於特別的突變(如在其他腫瘤中發現是核心變異)可特別進行報告。
對於生物學未明確分類的變異結果應收集整理,並提倡在同行間交換,為最終確認這些未明確分類的變異是功能性或非功能性的提供幫助。
對於不同瘤種的NGS數據,可以整合到同一個資料庫進行分析,這將有助於不同瘤種間變異資訊在臨床應用中的借鑒。
聲明29:報告格式和內容需標準化,應能適應短期未來的發展趨勢(靶點知識和檢測內容的變更)
報告內容應包括患者身份標識號、疾病資訊、樣本資訊、分析技術資訊、主要結果、結果解釋、操作員和實驗室專家(腫瘤分子生物學或遺傳學專家)簽字等。
聲明30:報告範圍應根據測試目的及測序能夠達到品質要求的覆蓋範圍來決定
例如在對外顯子組序列的檢測中,在肺癌中不一定報告所有覆蓋區域中檢出的變異。但需知情臨床醫師本次報告不能排除潛在的非關注區域的變異。
聲明31:NGS報告應簡明扼要、明確易懂
能充分提供必要資訊以供醫師參考用於當前臨床的靶向治療方案決策。
聲明32:結果解釋需客觀中肯,平實地描述腫瘤突變結果
在疾病相關性方面隻描述既往研究中的療效或預測相關性,不應出現建議使用何種治療手段或策略的文字。檢測結果在臨床決策中的應用應由臨床醫師或多學科專家討論決定。
聲明33:遺傳顧問需多學科支持
NGS數據用於臨床決策的制定過程中需與實驗室、癌症遺傳學、分子生物學、生物資訊學、病理學等多方面專家進行必要的資訊溝通。
知情同意
聲明34:NGS檢測項目開展前應向患者提供知情同意或相關遺傳顧問
應充分向患者解釋疾病條件下進行特定NGS檢測分析的目的和利弊。同時需向醫師及患者告知測試的局限性,包括驅動基因的資訊、報告範圍、技術分析的敏感度和特異度等。
知情同意書的內容至少必須包含:(1)進行基因檢測的依據,其中包括醫學指南、專家共識、治療規範等內容,需使患者知悉檢測的意義和目的;(2)基因檢測過程中可能有的局限性,如提取樣本量是否足夠,樣本品質控制指標是否適合基因檢測,如發生類似情況,需及時向患者以及家屬說明情況,再決定下一步;(3)進行基因測序可輔助個體化治療,但是最終決定須由臨床醫師決定;(4)基因檢測結果要只針對該次送檢樣本;(5)檢測機構必須對患者的身份資訊、病例資訊以及檢測結果等保密。患者進行基因檢測之前需知悉以上事項,並簽署知情同意書。
NGS用於研究與診斷的區別
由於技術的快速發展和應用部門的能力提升,NGS用於研究或是診斷的界限已經模糊,但在實際應用中,應明確特定的NGS測試是用於研究還是診斷。診斷目的的NGS檢測是為了回答臨床患者腫瘤中是否具有特定的基因變異狀態(可作用靶點的變異)。診斷檢測通常是在一個得到認證的實驗室開展。而研究目的的NGS檢測是研究假設驅動的檢測,檢測結果對入組患者通常隻具有有限或不確定的臨床意義。全外顯子或基因組測序的診斷結果由於數據量大,除了滿足特定的基因診斷,其他數據也可能產生新的研究假設。
聲明35:研究項目獲得有臨床意義的分子變異結果需進一步在診斷條件下確證後才可納入患者的醫療記錄
通常研究活動中發現的某種與臨床治療決策相關的靶點變異,需進一步採用已有的規範化或標準化的測試分析驗證後,才可以用於臨床實踐和納入醫療記錄。
聲明36:研究和診斷的檢測結果都應建立資料庫管理
NGS數據是當代疾病大數據的主要成分之一,資料庫建立也便於與本地、區域性的、國家或國際的資料庫進行比對分析,這有助於對變異進行臨床分類。
CAGC-POI項目NGS的監督管理
對於應用於CAGC-POI臨床實踐、試驗或研究的NGS檢測項目,為保證品質的同一性和延續性,將由CSCO CAGC專家組對所測試的NGS項目進行監督管理,管理方式包括現場考察、管理檔案和流程監督、測試樣本的室間評比等。目的是使得參與CAGC-POI項目的各個NGS實驗室能夠達到統一的品質標準。
委員會成員
共識制定專家組
組長:廣東省人民醫院(廣東省醫學科學院)腫瘤治療中心(吳一龍)
成員(排名不分先後):解放軍南京總醫院呼吸內科(宋勇),病理科(周曉軍);吉林省腫瘤醫院腫瘤內科(程穎),研究中心(李慧);中國醫學科學院腫瘤醫院病理科(應建明),腫瘤內科(王潔、徐兵河),內科實驗室(白樺);四川大學華西醫院病理科(劉衛平),腫瘤科(盧鈾);復旦大學附屬中山醫院病理科(侯英勇),腫瘤內科(劉天舒);暨南大學醫學院血液病研究室血液科(李楊秋),血液病研究所(田紅霞);解放軍第三〇七醫院腫瘤學研究室(劉毅),病理科(邰艷紅),腫瘤科(劉曉晴);華南理工大學第一臨床學院(候珺);解放軍第八一醫院腫瘤內四科(劉秀峰);中山大學附屬腫瘤醫院病理科(邵建永),結直腸科(陳功),腫瘤內科(徐瑞華);北京醫院病理科(王征);天津醫科大學腫瘤醫院乳腺腫瘤科(付麗);北京協和醫院病理科(梁智勇),呼吸內科(王孟昭);廣東省人民醫院(廣東省醫學科學院)腫瘤治療中心肺三科(周清),腫瘤內科(楊衿記),腫瘤外科(鍾文昭、楊學寧),乳腺科(廖寧),廣東省肺癌研究所(張緒超、陳宇);福建省腫瘤醫院胸部腫瘤內科(黃誠);復旦大學附屬腫瘤醫院病理科(周曉燕),乳腺外科(邵志敏);杭州市第一人民醫院轉化醫學中心(張仕蓉);上海交通大學醫學院附屬瑞金醫院血液研究所(任瑞寶),國家轉化醫學中心(上海)(王升躍);上海市肺科醫院病理科(武春燕);解放軍第一一三醫院腫瘤科腫瘤科(朱忠政);浙江大學醫學院附屬邵逸夫醫院腫瘤中心(潘巨集銘);江蘇省人民醫院腫瘤內科(顧艷巨集);上海交通大學醫學院附屬仁濟醫院腫瘤科(王理偉);中國醫科大學附屬第一醫院腫瘤內科(劉雲鵬);浙江大學醫學院附屬第二醫院腫瘤外科(張蘇展);哈爾濱醫科大學附屬腫瘤醫院腫瘤內科(張清媛);北京大學腫瘤醫院消化腫瘤內科(沈琳);上海交通大學附屬胸科醫院肺部醫學腫瘤中心(陸舜)
主要撰稿專家:廣東省人民醫院(廣東省醫學科學院)廣東省肺癌研究所(張緒超);北京協和醫院病理科(梁智勇);上海交通大學瑞金醫院國家轉化醫學中心(王升躍);上海交通大學附屬胸科醫院肺部醫學腫瘤中心(陸舜);廣東省人民醫院(廣東省醫學科學院)腫瘤治療中心(吳一龍)
志 謝
志謝廈門艾德生物醫藥科技股份有限公司(朱冠山);廣州燃石醫學檢驗所有限公司(揣少坤);北京雅康博生物科技有限公司(徐軍武);羅氏診斷產品(上海)有限公司(杜雷);北京基因加科技有限公司(楊玲);廣州精科生物技術有限公司(蔣馥蔓);上海思路迪精準醫療集團(熊磊);華大基因生物科技(深圳)有限公司(趙美茹);上海至本生物科技有限公司(王凱);北京諾禾致源生物資訊科技有限公司(蔣智)