科學家的手中不只負責一款候選藥物開發,這是普遍現象,因為還有許多領域的醫療需求未得到滿足。自1998年全球首個核苷逆轉錄酶抑製劑(NRTIs)拉米夫定(LAM)獲得美國食品藥品監督管理局(FDA)批準,這個領域依然還沒有產生臨床治愈率高的候選藥物。

B肝藥研現狀,新老機制藥物比較,哪些醫療需求尚未得到滿足?
B肝領域,預防性疫苗早於治療藥物開發上市,自1980年全球已有有效預防性B肝疫苗,可導致感染率顯著下降。干擾素上市也早於拉米夫定,干擾素-α是全球首個獲批用於治療慢性B肝藥物。早期開發的標準干擾素-α(IFN-α)和2005年開發的長效聚乙二醇化干擾素-α (Peg IFN-α) ,它們都具有免疫調節和抗病毒作用。
原理上,干擾素與NRTIs不同,NRTIs是通過競爭性地抑製逆轉錄酶來發揮抑製HBV複製作用。在長期藥物研究以來,NRTIs被科學家廣泛地證明其安全性和有效性,但此類藥物也存在長期使用後導致耐藥性問題。目前,拉米夫定、阿德福韋、替比夫定已經被耐藥發生率較低的恩替卡韋、富馬酸替諾福韋二吡呋酯和富馬酸替諾福韋艾拉酚胺取代成為B肝一線藥物。
從作用參數上,這些NRTIs可以高效地抑製血清中的HBVDNA,使血清轉氨酶正常化,防止肝病進展並減少發展成為HCC。NRTIs不直接抑製cccDNA,也無法根除cccDNA,而IFN使用與嚴重不良事件相關,這也是為什麽NRTIs成為B肝藥物市場主流藥物的重要原因,但這兩種作用機制截然不同的藥物,都還無法實現較高的功能性治愈率(臨床治愈率)。

正是因為以上B肝藥物現狀,全球科學家才要積極開發針對HBV生命周期不同步驟候選藥物,比如衣殼抑製劑、治療性疫苗、PD-1/PD-L1、siRNA、ASO、cccDNA抑製劑等等。那麽,開發這些候選藥物與以往的NRTIs或IFN有什麽不同呢?我們可以通過以下對已知完整的HBV生命周期介紹,發現一些適合產生新藥物的靶點。
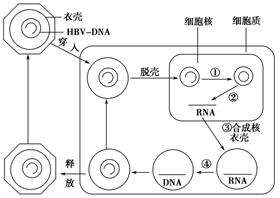
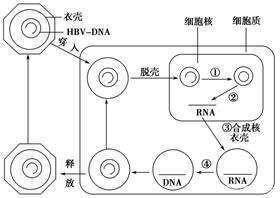
HBV進入肝細胞後,內體外殼攜帶含有松弛環狀DNA(rcDNA)的病毒核衣殼穿過細胞質到達細胞核。病毒衣殼附著在核孔複合物上,這時要麽基因組被釋放到細胞核中,要麽整個衣殼被內化。這個過程,可以逃避細胞質中的宿主先天免疫反應。在細胞核中,宿主細胞酶DNA聚合酶k和α、DNA連接酶以及拓撲異構酶I 和II 被病毒劫持,以幫助將rcDNA完成為完整的共價閉合環狀DNA(cccDNA)。
這是通過消除負 (-) 鏈 5' 末端的 pol 連接末端冗余序列和正 (+) 鏈 5' 末端的 RNA 寡核苷酸(引物),然後使用連接酶將這兩條鏈結合來完成的。rcDNA的 (-) 鏈有四個主要的開放閱讀框 (ORF);即 S、P、PreC + C 和 X ORF。使用宿主細胞機制,cccDNA 被轉錄成亞基因組和前基因組 RNA (pgRNA),然後進入細胞質。在增強子和啟動子的調控下,病毒的mRNA被翻譯成大 (L)、中 (M) 和小 (S) 表面蛋白 (HBsAg)、HBeAg、核心 (HbcAg)、聚合酶 (pol) 和 HBx 蛋白。
pgRNA 使用其稱為 epsilon (ε) 的順式作用衣殼化信號與細胞質中新翻譯的聚合酶特異性結合。然後在許多細胞伴侶(如 Hsc70、Hsp90 和 Hsp40)的幫助下,pgRNA-聚合酶複合物與衣殼二聚體連接。這導致在pgRNA-聚合酶複合物周圍構建由 30 nm 90 二聚體組成的 T-3 對稱二十面體核衣殼或由 34 nm 120 二聚體組成的 T-4 對稱二十面體核衣殼。

小番健康結語:已有許多基於上述部分HBV生命周期不同步驟開發新機制藥物,例如基因沉默療法沉默RNA(siRNA)、反義寡核苷酸(ASO)、針對衣殼裝配步驟的衣殼組裝調節劑(CAM)、核酸聚合物(NAP)、cccDNA抑製劑以及B肝病毒一開始進入細胞的步驟,由此開發病毒進入抑製劑。
這些針對不同步驟開發的新機制藥物,已正在進行臨床前研究或是1期、2期和3期臨床試驗階段。返回搜狐,查看更多
責任編輯: