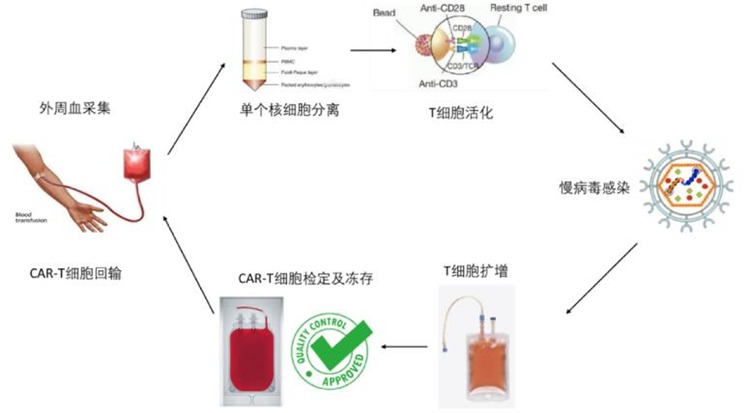
腫瘤免疫治療新貴CAR-T國內新進展 優卡迪臨床申報受理居首
來源:葯智網/三葉草


CAR-T細胞免疫療法,作為腫瘤免疫治療的新興手段之一,近年來一直備受業界關注。
CAR-T細胞免疫療法最早由Gross等於20世紀80年代末提出。至今已發展4代,由於第二代CAR-T有較多的臨床數據支持,穩定性高且技術工藝較為成熟,目前大多數企業CAR-T產品是在第二代CAR-T基礎技術上進行探索研究。2017年CAR-T細胞療法進入白熱化階段,諾華製藥和KitePharma分別上市了全球首個和第二個CAR-T,開創了CAR-T細胞療法的新紀元。值得提及的是CAR-T產品從申報上市到獲批僅僅隻用了6個月,速度超乎想像。
伴隨CAR-T在國際上的快速發展,國內也在加緊推動,2017年12月22日CFDA發布的《細胞治療產品研究與評價技術指導原則(試行)》,標誌著我國細胞治療產品作為藥品屬性的規範化臨床正式拉開序幕,極大的促進我國細胞治療產業的發展。2019年4月,國家葯監局啟動中國藥品監管科學行動計劃,將細胞和基因療法納入重點發展對象之一,至此國內的細胞療法迎來黃金發展期。
據公開數據不完全統計,全球現有超400餘項關於CAR-T療法臨床試驗的登記,其中中國登記的CAR-T療法臨床試驗項目僅次於全球申報最多的美國(美國是最早登記CAR-T療法試驗的國家),約有158項,佔全球的1/3左右。
21家企業臨床申報受理,優卡迪居首
據葯智藥品註冊與受理資料庫統計,截止目前,CDE共受理CAR-T產品臨床申報受理號31個,涉及復星凱特、上海明聚生物、科濟生物醫藥等21家企業。
其中優卡迪生物醫藥目前申報受理數量最多,有4個,目前已經審批完畢呈「已發件」狀態;其次是恆潤達生生物,有3個;上海科濟製藥、賽比曼生物、合源生物、北京藝妙醫療、以及廣州百暨基因5家企業申報2個;包括南京傳奇生物、成都銀河生物、上海明聚生物等在內的14家企業目前均有1個申報獲受理。
值得提及的是南京傳奇生物儘管只有1個CAR-T產品申報臨床註冊,然而該產品卻是國內首個按「治療用生物製品1類新葯」申請獲得CDE受理的CAR-T產品,並獲得優先審評資格,於2018年3月12日獲批臨床,成為國內首個按藥物申報臨床試驗獲批的CAR-T療法。南京傳奇生物的該產品,從2017年12月8日獲得受理到2018年3月12日獲批臨床,用時僅3個月,可見對於創新葯的審評審批速度在不斷加快。
13個產品獲批臨床,2個已進入Ⅱ期
除南京傳奇生物的CAR-T產品已經獲批臨床試驗外,還有12個也已獲批臨床,並且成都銀河生物、科濟生物、恆潤達生生物CAR-T產品同南京傳奇生物一樣為特殊審批兼優先審評;其中,成都銀河生物的CAR-T產品是國內首個針對CD19靶點獲得受理並唯一納入優先審評的產品。此外,上海細胞治療的CAR-T產品雖未被納入特殊審批或者優先審評,但也於今年1月份獲批臨床,並且是國內首個獲批臨床的非病毒載體CAR-T細胞治療產品。
CAR-T產品已獲批臨床詳情


據葯智中國臨床資料庫統計,上海明聚生物和南京傳奇的CAR-T產品目前已經進入臨床Ⅱ期。除以上獲批臨床的兩個產品外,深圳因諾、河南華隆生物和天津天銳生物的產品也臨床試驗已進入Ⅱ期。目前進入臨床Ⅱ期的產品基本都是用於複發難治性B細胞非霍奇金淋巴瘤、多發性骨髓瘤、白血病等血液腫瘤,詳情可見下表:
進入臨床Ⅱ期CAR-T產品詳情


CAR-T由血液瘤向實體瘤延伸,成績可喜
據長城證券報告,目前75%的在研CAR-T項目擬用於白血病、淋巴瘤等血液腫瘤,有小部分的在研項目針對肝癌、肺癌等實體腫瘤。有觀點指出,從血液瘤延伸至實體瘤會是CAR-T研究的一個大趨勢。據西南證券報告,全球血液瘤市場近300億美元,中國達100億人民幣,實體瘤市場超千億,市場空間巨大。
因此,近年來,全球對於CAR-T療法用於實體瘤的科學研究在不斷創新突破。近日,在2019ASCO摘要發布了一項CAR-T細胞治療胃、胰腺癌實體腫瘤的臨床數據,有效率達到了33.3%,安全可耐受,有力的證明了CAR-T細胞治療在實體瘤中的應用性。
與此同時,國內企業針對CAR-T在實體瘤的研究同樣在不斷攻克,其中科濟生物尤為耀眼,其專註於研究CAR-T在實體瘤上的運用。2015年科技生物在上海交通大學醫學院附屬仁濟醫院開展了全球首個針對肝細胞癌的CAR-T細胞臨床實驗;2018年科濟生物在美國波士頓CAR-TCR峰會公布了CAR-T細胞治療胃癌/胰腺癌的臨床數據:在接受治療的12名患者中,有8名患者出現不同程度腫瘤消退,特別是在一個經過改良的治療亞組中,按照RECIST1.1標準,6名患者有5名達到客觀緩解(其中1名待確認客觀緩解),包括1名完全緩解。有了突破性的進展。今年1月,科濟生物又宣布在研產品GPC3靶向的CAR-T細胞用於治療GPC3陽性實體腫瘤的臨床試驗申請已通過了國家藥品監督管理局藥品評審中心(CDE)的默示許可(受理號CXSL1700203),成我國首個用於治療實體瘤的CAR-T細胞藥物臨床試驗許可。
相信隨著技術的進步,研究人員的堅持不懈,以及國家政策的協助,CAR-T將攻克更多的血液瘤和實體瘤,為癌症患者帶來福音。
附:CDE受理CAR-T產品IND申報詳情


註:文中數據皆為手動搜索、如有遺漏歡迎補充
信息來源:葯智網、企業公告等網路公開信息
數據來源:葯智數據、西南證券、長城證券等