德琪醫藥近日宣布,公司一類創新葯ATG-010(selinexor)已獲得國家藥品監督管理局的臨床試驗批件,目標適應症為 接受過含免疫調節劑和蛋白酶抑製劑方案的難治複發多發性骨髓瘤。據悉,selinexor是全球首款用於治療難治複發多發性骨髓瘤的選擇性核輸出抑製劑(selective inhibitor of nuclear export, SINE),也是全球首創的SINE口服抗癌藥物。2018年5月,德琪醫藥從Karyopharm公司取得了這款創新葯在亞洲不同國家和地區的開發和商業化的獨佔許可。值得一提的是,這款藥物在中國獲批臨床,成為德琪醫藥繼肝癌治療新葯ATG-008啟動臨床試驗後,第2款在中國大陸獲批臨床的新葯,也是德琪醫藥在創新葯開發征程中的又一大進展。Selinexor是一款全新靶點、全新機制的抗癌新葯。資料顯示,該藥物 通過結合併抑製核輸出蛋白XPO1(也稱為CRM1)而起作用,並導致腫瘤抑製蛋白在細胞核中累積,從而重新啟動和放大其作為腫瘤抑製劑的功能,導致癌細胞中的細胞凋亡的選擇性誘導,同時很大程度上讓正常細胞免受損傷。在中國,隨著這款葯獲批臨床, 德琪醫藥針對其目標適應症的臨床試驗也即將啟動。據悉,該臨床試驗為一個開放性、單臂臨床研究,主要目的是評估ATG-010聯合低劑量地塞米松在既往接受過含免疫調節劑和蛋白酶抑製劑方案的難治複發多發性骨髓瘤患者中的葯代動力學特性、有效性及安全性耐受性。 在全球,針對selinexor的申報註冊也在加速。據悉,迄今已有超過2800名患者接受了這款葯的治療。Selinexor已被授予多發性骨髓瘤的孤兒藥物的稱號以及快速審評通道資格。而且,Karyopharm公司已啟動selinexor用於治療五線複發多發性骨髓瘤患者新葯上市申請(NDA)的滾動遞交(rolling submission),且在2019年初向歐洲藥品管理局(EMA)遞交加速評估新葯上市申請。德琪醫藥公司創始人、董事長梅建明博士表示:「對於難治複發的多發性骨髓瘤,中國患者亟需一種新的作用機制的創新療法。經過前期合作夥伴美國Karyopharm及各位同事的不懈努力,經過同國內外血液腫瘤專家密集深入的溝通,此次ATG-010順利獲得臨床研究批件,標誌著口服ATG-010離中國患者又近了一步。」德琪醫藥是一家專註於新葯開發,臨床研究和市場銷售的創新葯公司,專註於解決亞洲地區未被滿足的醫療需求,並力爭為中國及亞太地區的患者提供最前沿和領先的抗腫瘤和抗病毒創新藥物。目前,德琪醫藥擁有五個臨床研發階段的產品:
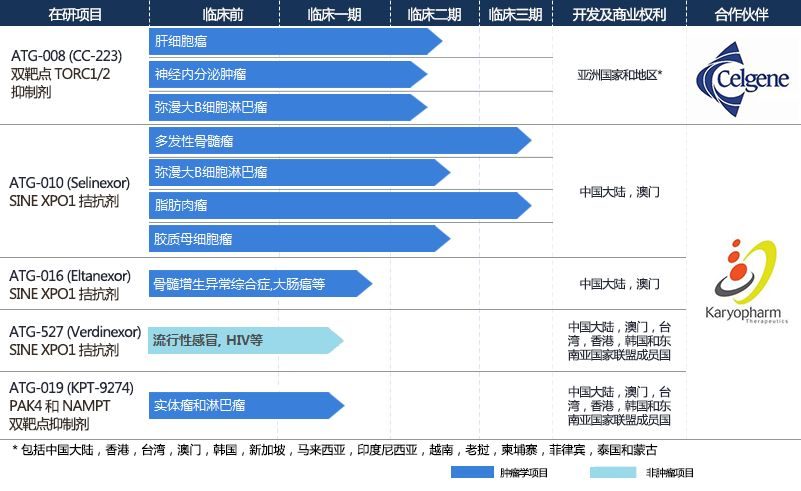

德琪醫藥研發管線(圖片來源:德琪醫藥公司官網)
- ATG-010是一款在多發性骨髓瘤(multiple myeloma, MM)、瀰漫性大B細胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)及多種實體瘤分別處於NDA申報及臨床2/3期階段的在研產品;
- ATG-008已在包括中國大陸、中國台灣和韓國在內的多個地區開展亞太多中心肝癌臨床研究;
- ATG-016和ATG-019是兩款處於臨床1/2期階段的專註於癌症治療的新靶點和機制的在研產品,正在進行關於治療包括骨髓增生異常綜合征(myelodysplastic syndrome,MDS)、結腸直腸癌、攝護腺癌在內的多個癌症種類的臨床研究;
- ATG-527是一款臨床在研抗病毒藥品,目前正在進行關於治療流感、呼吸道合胞病毒(RSV)及人類皰疹病毒(EBV)感染等相關疾病的臨床研究,並已完成1期臨床研究。
德琪醫藥表示,2019年公司將有多款產品進入2/3臨床階段,將會是臨床批件的「豐收年」。對於患者來講,只有藥物早日上市,才能分享全球創新藥物的研發成果,所以,今年依然是一個「播種年」。公司一切努力的最終目的,就是讓臨床試驗用藥早日造福中國和亞太患者。
參考資料:
[1]ATG-010,中國首個用於治療多發性骨髓瘤的選擇性核輸出抑製劑獲批臨床批件 . Retrieved Feb 12from 德琪醫藥官微







