7月3日,專註於腫瘤領域的創新葯企德琪醫藥與合作夥伴Karyopharm Therapeutics Inc.(以下簡稱Karyopharm,納斯達克股票代碼:KPTI)宣布,美國食品和藥物管理局(FDA)正式批準合作開發的全球首款核輸出抑製劑XPOVIOTM(selinexor,德琪醫藥產品代號ATG-010)與低劑量地塞米松聯合用於治療複發難治多發性骨髓瘤(RRMM)。
全文1617字,用時5分鐘
7月3日,專註於腫瘤領域的創新葯企德琪醫藥與合作夥伴Karyopharm Therapeutics Inc.(以下簡稱Karyopharm,納斯達克股票代碼:KPTI)宣布,美國食品和藥物管理局(FDA)正式批準合作開發的全球首款核輸出抑製劑XPOVIOTM(selinexor,德琪醫藥產品代號ATG-010)與低劑量地塞米松聯合用於治療複發難治多發性骨髓瘤(RRMM)。這些患者至少接受過包括蛋白酶體抑製劑,免疫調節劑和CD38單克隆抗體在內的多線治療。此外,一項評估selinexor與硼替佐米和低劑量地塞米松聯合用於治療複發難治多發性骨髓瘤的三期臨床試驗(BOSTON)已經完成患者入組。FDA的加速審批為複發難治的多發性骨髓瘤患者提供了一款與現有臨床藥物完全不同機制的創新葯。
西奈山醫學院(Mount Sinai School of Medicine)多發性骨髓瘤項目主任兼血液學和腫瘤內科教授,STORM臨床試驗的主要研究者Sundar Jagannath博士表示:「在關鍵的2b STORM臨床試驗中,83位患者亞組中觀察到25.3%的總體反應率具有臨床意義,這個總體反應率也是作為XPOVIOTM得到FDA加速批準的基礎,且其預示著患者將獲得臨床受益。」
Dana-Farber癌症研究所Jerome Lipper多發性骨髓瘤研究中心的臨床項目負責人和中心主任Paul Richardson博士表示:「儘管最近在多發性骨髓瘤的治療方面業界取得了一些進展,但幾乎所有我們的患者都會對目前可用的五種最常用的抗骨髓瘤藥物產生抗藥性,且此患者群體的預後尤其糟糕。口服XPOVIOTM的加速批準標誌著selinexor可能為那些已經嘗試過所有現有療法的複發難治患者提供一種令人興奮的新治療選擇。」
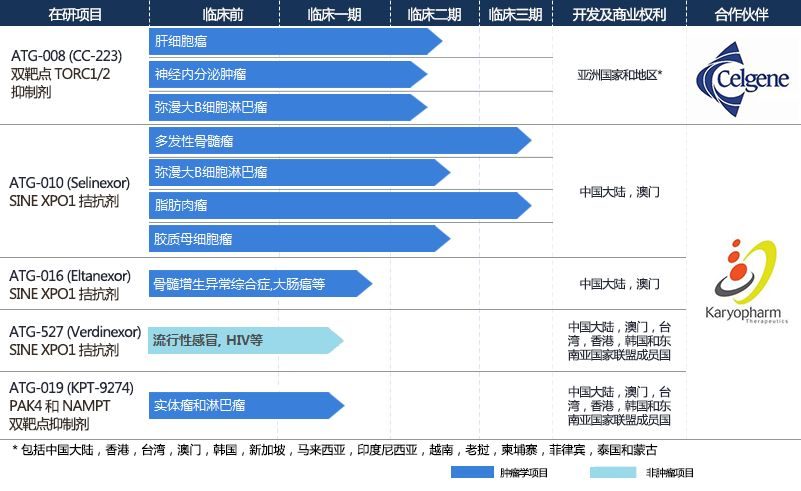
德琪醫藥創始人、董事長兼首席執行官梅建明博士表示:「XPOVIOTM(selinexor)在美國獲批上市的消息十分鼓舞人心。對於複發難治的多發性骨髓瘤,中國患者同樣亟需一種全新作用機制的創新療法。對於中國患者的迫切需求,我們感到了責任的重大和時間的緊迫。Selinexor(ATG-010)在中國用於治療晚期複發難治多發性骨髓瘤的臨床試驗已經獲得了葯監機構的批準,並預計於今年8月患者開始接受治療。此外,我們還將繼續研究selinexor用於治療包括瀰漫大B淋巴瘤、T細胞淋巴瘤、子宮內膜癌及腦膠質瘤在內的多種其他血液及實體瘤腫。我們期待儘快將這款創新葯帶給中國患者。」
德琪醫藥的合作夥伴Karyopharm Therapeutics的創始人、總裁兼首席科學官Sharon Shacham博士表示:「隨著今天XPOVIOTM獲得FDA的加速批準,複發難治多發性骨髓瘤的患者現在有了一個全新的治療選擇。」她同時表示,「研發一個如 XPOVIOTM一樣具有全新作用機制的創新藥物,並能順利獲得FDA的批準,需要許多人的努力與奉獻,其中包括參與我們臨床試驗的患者、家屬、護理人員以及醫生。我們非常感謝大家對這一重要里程碑的貢獻,也非常期待在致力於提高腫瘤患者生存質量的努力中,未來取得更大的突破。」
2018年5月29日,德琪醫藥與Karyopharm在上海簽署戰略合作協議,共同開發包括ATG-010(XPOVIOTM,selinexor)在內的四款處於臨床開發階段的口服創新藥物。合作啟動後,ATG-010於2019年1月28日獲得中國國家藥品監督管理局臨床批件,即將在今年8月啟動臨床試驗。據悉,除了持續推進ATG-010在多發性骨髓瘤以外的相關適應症的研發,德琪醫藥正在組建商業化團隊,積極準備selinexor及後續產品的上市工作。
關於XPOVIOTM (selinexor)
XPOVIOTM是一種全球首創、口服、選擇性核輸出抑製劑(SINE),通過結合併抑製核輸出蛋白XPO1(又名CRM1)發揮作用,導致腫瘤抑製蛋白在細胞核內積累,從而重新啟動和放大其作為腫瘤抑製劑的功能,導致癌細胞的細胞凋亡,同時很大程度上讓正常細胞免受損傷。XPOVIOTM在治療硼替佐米,卡非佐米,來那度胺,帕馬度胺和daratumumab治療失敗複發難治多發性骨髓瘤適應症於2019年7月被FDA加速批準之外,另外也已向歐洲藥品管理局(EMA)遞交了歐洲行銷授權申請(MAA)。同時,selinexor也正在複發或難治瀰漫性大B細胞淋巴瘤(DLBCL)適應症上進行臨床研究。在2018年,Karyopharm彙報了在至少兩線複發難治的DLBCL患者的名為SADAL的臨床2b期試驗的研究結果,且已被FDA授予快速審批資格(Fast Track designation)。此外,Selinexor 也正在進行用於治療多種癌症適應症的多項中期和後期臨床試驗,其中包括其聯合硼替佐米 (bortezomib)和低劑量地塞米松治療多發性骨髓瘤的三期臨床試驗(BOSTON)、以selinexor作為潛在主要治療藥物,並與其他已上市多發性骨髓瘤藥物聯合使用的臨床試驗(STOMP)、脂肪肉瘤(SEAL)、複發腦膠質瘤(KING)以及子宮內膜癌(SIENDO)等多項臨床研究。