近期,南京鼓樓醫院消化科鄒曉平、呂瑛教授團隊成功診治了一例少見的自身免疫性胰腺炎(Autoimmune Pancreatitis, AIP)—2型AIP。
作者丨呂瑛 彭春艷 張松
AIP是一種以梗阻性黃疸、腹部不適等為主要臨床表現的特殊類型的胰腺炎。該病由自身免疫介導,以胰腺淋巴細胞及漿細胞浸潤並發生纖維化、影像學表現胰腺腫大和胰管不規則狹窄、血清IgG4 水準升高、類固醇激素療效顯著為特徵。AIP按組織學表現分為1型和2型,1型又稱為淋巴漿細胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis, LPSP),2型又稱為特發性導管中心性慢性胰腺炎 (idiopathic duct centric pancreatitis, IDCP)。
自1995年AIP的概念被首次提出以來,我們對AIP的認識不斷提高,具有典型影像學特徵、血清或組織IgG4明顯升高的病例相信已經難不倒大家了,但是,對於影像學懷疑AIP但IgG4陰性的病例,臨床思維該如何建立?相信下面這個案例的分享會給大家帶來啟發。
01
初現端倪,疑點重重
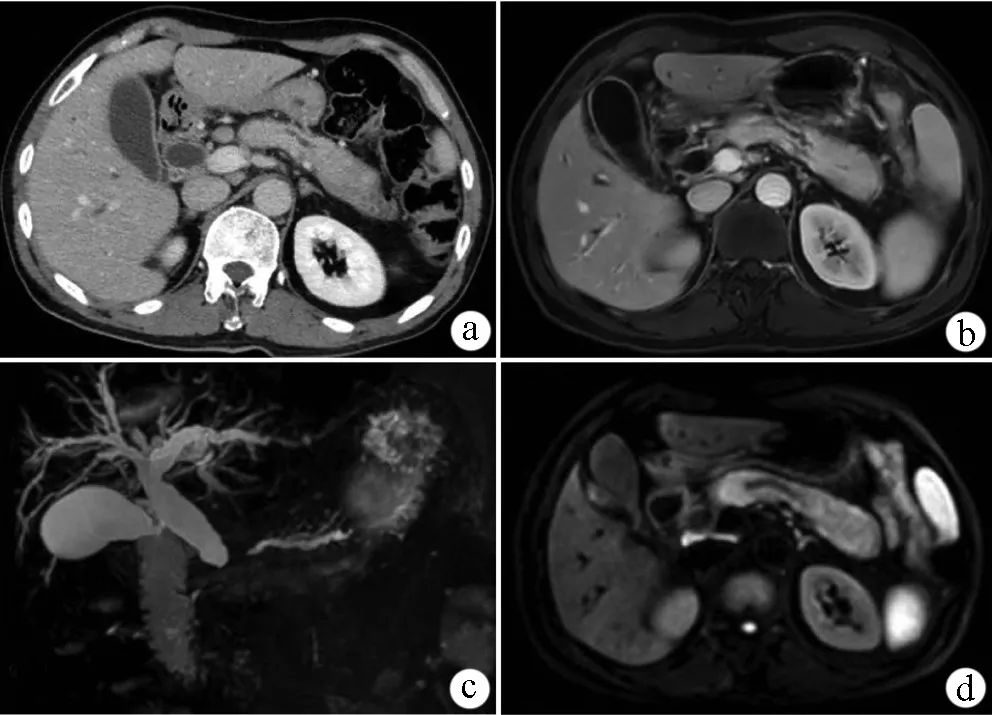
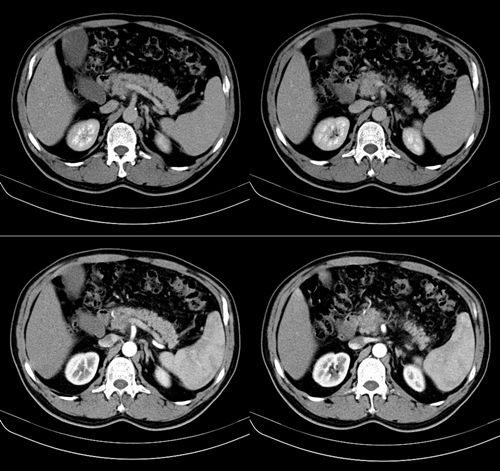
患者37歲,男性,因「上腹痛一月余」入院。患者一月余前突發上腹痛,伴有後背痛,至外院急診就診,查血清澱粉酶:376U/L,肝功能正常;電子胃鏡提示淺表性胃炎,HP(-);腹部CT平掃提示胰腺體積稍增大,腹腔多發小淋巴結(見圖1)。急診診斷考慮為急性胰腺炎可能,給予抑酸、抑製胰腺分泌及營養補液等對症支持治療,後患者上述癥狀略有好轉。


圖1:腹部CT平掃提示胰腺體積稍增大,
腹腔多發小淋巴結
兩周後複查血清澱粉酶較前下降(116U/L),進一步完善MRCP提示胰腺形態飽滿,脾大,腹腔多發小淋巴結,膽、胰管未見明顯擴張(見圖2)。


圖2:MRCP提示胰腺形態飽滿,脾大,
腹腔多發小淋巴結,
膽、胰管未見明顯擴張
入院前四天,患者再發上腹痛及後背痛,大便帶血,伴有發熱,熱峰38.8℃,複查血清澱粉酶:72U/L,複查腹部CT結果較前相仿。患者為進一步診療,急診擬「急性胰腺炎」收住入院。
回顧患者的病史,我們難免心生困惑,患者反覆發作上腹痛的原因到底是什麼?雖然病程中反覆發作腹痛,澱粉酶有輕度升高,CT/MRI提示胰腺腫大,但給患者扣上「急性胰腺炎」的帽子就可以高枕無憂了嗎?同時,患者病程中出現的便血和發熱原因為何?是否可以用「一元論」來解釋?
02
真假李逵,元兇為何
帶著這些困惑,我們為患者進一步完善了相關檢查。入院後查血清免疫球蛋白IgG4為0.03g/L,在正常值範圍;查大便培養、EB病毒、巨細胞病毒、T細胞γ干擾素、肝炎全套、降鈣素原等感染指標均為陰性;查自身抗體、抗中性粒細胞胞漿抗體、線粒體抗體譜等免疫指標也均為陰性。
但是,一個月內患者肝功能出現了顯著的異常,肝酶和膽系酶均出現不同程度的升高(谷丙轉氨酶:499.0U/L,穀草轉氨酶:205.9/L,鹼性磷酸酶:243.7U/L,谷醯轉肽酶:132.4U/L)(見圖3)。


圖3:患者複查肝功能提示肝酶和膽系酶
均出現不同程度的升高
為明確患者肝功能異常的原因,建議患者複查MRCP。MRCP提示胰腺瀰漫性腫脹似呈臘腸狀,周圍似見假包膜,膽總管中下段狹窄伴以上肝內外膽管擴張,胰管未見明顯異常,膽囊體積增大,脾大(見圖4)。我們推測患者肝功能異常可能與膽管狹窄繼發膽道高壓有關,然而,是什麼原因導致膽管在短時間內出現如此顯著的變化(見圖5)?患者「臘腸狀的胰腺」成為我們關注的焦點,影像學資料及生化指標提示患者1型AIP的可能性大,但反覆多次血清IgG檢查均為陰性。


圖4:MRCP:胰腺腫脹更為明顯,呈臘腸狀,
周圍似可見假包膜,膽囊張力增高,
膽管的胰腺段纖細且近端肝內外膽管顯著擴張
圖5:MRCP:(右圖)膽囊張力增高,
膽管的胰腺段纖細且近端肝內外膽管顯著擴張,
與前片(左圖)形成鮮明對比
為解除膽道高壓以及明確膽管狹窄原因,我們為患者實施了ERCP及相關技術。術中造影顯示膽總管下段狹窄,胰管粗細不均但不擴張;IDUS顯示膽管壁無明顯增厚(見圖6)。術中膽管細胞刷檢未查見惡性腫瘤細胞;為進一步明確診斷我們進行了十二指腸乳頭活檢,但活檢病理顯示慢性活動性小腸炎,固有膜內見多量漿細胞浸潤(密集區域約200個/HPF)及少量嗜酸性粒細胞浸潤,IgG4(-)。患者ERCP術中可見膽總管下段狹窄,IDUS顯示狹窄段管壁結構正常,因此考慮膽總管狹窄為腫大的胰腺壓迫所致。


圖6:ERCP術中造影顯示膽總管下段狹窄;
胰管粗細不均但不擴張;
IDUS顯示膽管壁無明顯增厚;
術中於膽管置入塑料支架一枚,可見膽汁引出
因患者病程中有便血,入院後查大便隱血陽性,我們為患者完善了電子腸鏡檢查,結果顯示全結腸黏膜充血、水腫,散在糜爛,血管紊亂模糊(見圖7);同期病理示(降結腸)慢性活動性腸炎伴隱窩膿腫形成。患者腸鏡表現可疑為早期潰瘍性結腸炎(UC),建議患者密切隨訪。


圖7:電子腸鏡提示全結腸黏膜充血、水腫,
散在糜爛,血管紋理模糊
03
水落石出,真相大白
患者病程中CT/MRI影像學檢查提示胰腺瀰漫性腫大,呈臘腸樣改變,似可見假包膜,符合AIP的影像學特點,但患者血清IgG4在正常值範圍,組織學(十二指腸乳頭)病理示IgG4陰性,同時患者合併可疑潰瘍性結腸炎,診斷傾向於2型AIP可能。因此,我們鎖定腫大的胰腺,完善胰腺CT平掃+增強,並通過「胰腺疾病最完美的診斷方法」—EUS-FNA獲取病理學依據。
胰腺CT平掃+增強提示胰腺體積增大伴強化欠均勻,脾臟體積增大,腹腔多發淋巴結(見圖8);超聲內鏡顯示胰腺回聲偏低,瀰漫性腫大,胰管無擴張,超聲造影顯示高增強,提示胰腺組織富血供(見圖9);我們使用19G穿刺針為患者實施了EUS-FNA術,術後病理示胰腺腺泡呈小葉狀分布伴多量急慢性炎症細胞浸潤,部分小葉內部分腺泡萎縮,纖維組織增生,部分腺泡內見多量中性粒細胞浸潤並浸潤腺泡上皮;萎縮的小葉內和腺泡間間質纖維化;免疫組化示IgG4陰性。


圖8:胰腺CT平掃+增強:胰腺體積增大
伴強化欠均勻,
脾臟體積增大,腹腔多發淋巴結


圖9:EUS顯示胰腺回聲偏低,瀰漫性腫大,
胰管無擴張,
超聲造影顯示高增強,提示胰腺組織富血供
對照2011年頒布的AIP國際診斷標準(見圖10)[1]典型的影像學特徵:增強CT示胰腺實質延遲期不均勻強化;
典型的胰管顯像:ERP示胰管局段纖細且不伴近端胰管的擴張;
臨床診斷炎症性腸病可能:患者腸鏡及活檢病理提示潰瘍性結腸炎(UC)可能;
特徵性的病理學表現:EUS-FNA病理提示腺泡內多量中性粒細胞浸潤並浸潤腺泡上皮且IgG4陰性。
患者如果激素治療有效,可確診為2型AIP。因此,排除激素使用禁忌後,患者開始口服強的松 30mg qd(30mg,1次/日),治療一月後患者癥狀完全緩解,複查腹部CT提示胰腺體積較前明顯縮小(見圖11),提示激素治療有效。






圖11: CT提示胰腺體積較前明顯縮小
這例2型AIP的診治同樣給我們帶來一些思考。目前一致認為組織學檢查為診斷AIP的金標準,但想獲得滿意的活檢標本較為困難。開腹探查取得的病理結果陽性率高,但創傷大,用於AIP的診斷顯然行不通。EUS-FNA自1992年Vilmann等[2]首次應用以來,已被廣泛應用於多種疾病的診斷,是胰腺疾病「近乎完美的診斷方法」。然而,EUS-FNA獲取的組織量較少,有時不能滿足AIP診斷的需要。AIP的病理評估需要觀察小葉間導管和腺泡的炎症浸潤情況,因此,對AIP患者實施EUS-FNA需儘可能的獲取滿意的組織條。文獻報導顯示,使用組織活檢針進行EUS-FNB所獲取的病理,至少可以達到AIP國際診斷標準2級的要求[3]。EUS-FNB為AIP的診斷打開了新的思路,今後有望成為AIP安全、高效的組織獲取手段。參考文獻:
[1] Tooru Shimosegawa, Suresh T. Chari, Luca Frulloni, et al. International Consensus Diagnostic Criteria for Autoimmune Pancreatitis. Pancreas 2011;40: 352-358
[2] Vilmann P, Jacobsen GK, Henriksen FW, et al. Endoscopic ultrasonography with guided fine needle aspiration biopsy inpancreatic disease. Gastrointest Endosc, 1992, 38:172-173.
[3] Detlefsen S, Joergensen MT, Mortensen MB.Microscopic findings in EUS-guided fine needle (SharkCore) biopsies with type 1 and type 2 autoimmune pancreatitis. Pathol Int. 2017, 67(10): 514-520.
考考你