WOS發現歷程
八尾建史等已經證明基於MVP的ME在臨床上可用於通過回顧性和前瞻性研究來區分胃癌和非癌性病變。當他們通過ME研究淺表平坦(0-IIb)型或淺表凹陷(0-IIc)型的胃病變時,不規則MV模式是區分癌與非癌的最重要的特徵,準確性高達98.7%。
八尾建史團隊應用放大內鏡觀察0-IIa型的胃腫瘤病變時,有時難以清楚地看到腫瘤病變內上皮下微血管的構造。根據之前的經驗,他們意識到無法觀察到上皮下MVP的原因不是由於技術問題所致,而是由於腫瘤上皮內的一些WOS掩蓋了上皮下MVP的現象。

圖1 0-IIa型腺瘤中NBI的ME表現:存在具有規則分布的WOS。 由於密集的WOS掩蓋了上皮下MVP,因此無法觀察到上皮下MVP。WOS顯示出良好組織和對稱的分布,具有規則的網狀圖案。

圖2 0-IIa型早期胃癌中NBI的ME發現:存在具有不規則分布的WOS。 由於一些WOS存在於癌性上皮內,因此不能清楚地看到上皮下MV模式。WOS顯示出具有不規則斑點圖案的結構和不對稱分布,即與圖1相比明顯不規則的形態。
WOS的性質可能是上皮下累積的脂滴
據報導,在十二指腸內的散發性上皮瘤中也存在WOS,並且該WOS的性質可能是在十二指腸腫瘤上皮吸收、累積的脂滴(LD)。
由於脂滴具有比細胞內細胞器和組織有機成分更高的反射指數。脂滴被歸類為Mie散射粒子。因此,投射的光被脂滴強烈地散射和反射。因此,當在黏膜的上皮和上皮下部分中累積的脂滴強烈地散射並反射投射的光時,投射的光不能到達位於上皮下面的微血管中的血紅蛋白。因此,不透明度增加。另外,這種強烈的向後散射和光反射被人眼識別為白色。因此,累積的脂滴可能是WOS的原因。
脂滴在上皮和上皮下積聚的機制尚不清楚。有兩種可能的機制,一種是脂滴來源於上皮表面吸收的外部脂質(吸收假說)。另一種是腫瘤細胞本身從毛細血管提供的葡萄糖或脂質中合成脂滴(生產假說)。
消化和吸收脂質的正常過程如下:口服攝入的脂質與胃及舌脂肪酶組合,其中水解將約10%的甘油三酯轉化為甘油和遊離脂肪酸。通過小腸的脂質將膽汁鹽和脂質分解產物乳化,然後以微小脂滴的形式分散在水溶液中。胰脂肪酶、膽固醇酯酶、磷脂酶A2和脂肪酶有助於脂滴的消化。脂質消化的最終產物 - 甘油單酯、脂肪酸、膽固醇、溶血磷脂和遊離脂肪酸 - 溶解在膠束中,然後分散到小腸上皮細胞的刷狀緣。膠束需要穿過刷狀邊界非分散層,並根據濃度梯度通過細胞。因此,脂質吸收需要產生乳化膠束。
腸上皮化生的上皮有能力吸收類似於正常小腸上皮的脂滴。從外部消化的脂質(脂肪酸和甘油單酯或甘油二酯)在腸上皮細胞和腸上皮化生的情況下被吸收後在上皮內再合成甘油三酯並聚積成脂滴。累積的脂滴來自消化的膠束脂質。為了吸收脂質,高達20%的膳食甘油三酯可以在正常胃內脂解和形成膠束。此外,膽汁和胰液已經迴流到萎縮性胃,其管腔內容物不是酸,可能已經能夠水解腔內的甘油三酯甚至形成膠束。
小腸中乳糜微粒被排出到腸絨毛尖端的固有層內的淋巴管中。由於胃中的固有層的解剖結構與小腸的解剖結構不同。有研究發現61.5%的脂滴陽性腫瘤顯示脂滴在上皮內和上皮下積聚。因此,推測在具有腸型的腫瘤細胞中形成乳糜微粒後,累積的脂滴已被轉運至上皮下部分。然而,由於胃中的黏膜淋巴管在解剖學上僅存在於固有層的最深層,因此脂滴不能容易地轉運到淋巴管中。因此,它們可以保留在黏膜的表面部分較長時間。
WOS的定位於上皮頂端或隱窩上皮
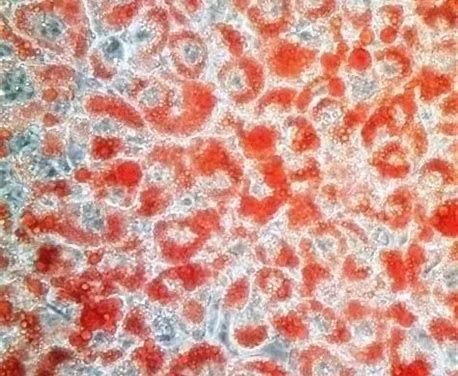
脂肪主要存積於脂肪組織中,並以油滴狀的微粒存在脂肪細胞漿內。 在病理檢驗中,脂類染色法最常用以證明脂肪變性、脂肪栓子以及腫瘤的鑒別。脂類染色使用最廣泛的染料是蘇丹染料,最常用的有蘇丹Ⅲ、蘇丹Ⅳ、蘇丹黑及油紅O等。油紅 O屬於偶氮染料,是很強的脂溶劑和染脂劑,與甘油三酯結合呈小脂滴狀。脂溶性染料能溶於組織和細胞中的脂類,它在脂類中的溶解度比在溶劑中大。當組織切片置入染液時,染料則離開染液而溶於組織內的脂質(如脂滴)中,使組織內的脂滴呈橘紅色。
八尾建史團隊報導根據油紅O染色,發現吸收的脂滴僅位於隱窩之間的相對頂端部分的黏膜表面。


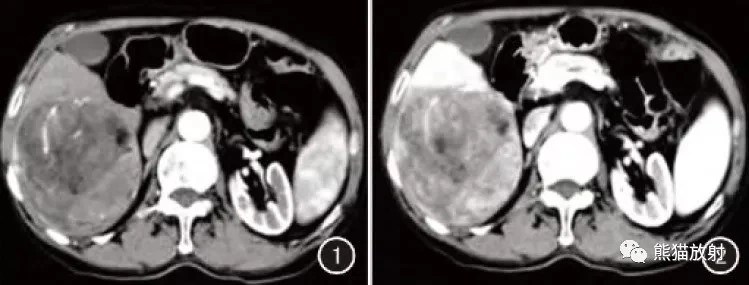
(a)0-IIa型低度惡性腫瘤(腺瘤)白光的標準內鏡檢查結果。 在胃賁門的較小曲率處可以看到淺表蒼白的隆起性病變(箭頭)。 (b)具有窄帶成像(NBI)發現的放大內窺鏡檢查(ME)。 當放大腫瘤的邊緣部分時,在背景黏膜中可以看到明顯的褐色上皮下毛細血管。 然而,在病變邊緣內的腫瘤黏膜(箭頭)中,微血管圖案不可見,因為一些WOS遮蔽了腫瘤上皮下面的上皮下微血管結構。 (c)來自瘤形成的活檢標本的組織病理學發現(油紅O染色,100×)。 各種尺寸的橢圓形無定形LD已累積在腫瘤組織的上皮和上皮下部分中。
(a)標準的內鏡檢查結果,白光為0-IIc型高級別腫瘤。在胃竇的後壁可以看到輕度凹陷的紅色病變(箭頭)。 (b)具有窄帶成像(NBI)發現的放大內窺鏡檢查(ME)。背景黏膜和腫瘤病變之間有明確的分界線(箭頭)。褐色上皮下毛細血管可在背景黏膜中清晰可見。相反,由於在分界線內的瘤形成中存在精細斑點的WOS,因此不能清楚地看到上皮下微血管結構。 (c)來自瘤形成的活檢標本的組織病理學發現(油紅O染色,200×)。通過油紅O染色,在單獨的腫瘤上皮內證實了許多圓形或橢圓形無定形LD。
adipophilin,又名脂肪分化相關蛋白(ADRP),是一種脂滴周圍主要的相關蛋白,它大量分布在脂質蓄積正常或不正常的細胞中,足脂質蓄積的特異性標誌物主要表達於分化早期的脂肪細胞。adipophilin是細胞內脂肪貯存滴囊泡的主要成分之一,也是脂肪細胞、單核巨噬細胞脂質沉積的標誌。有研究表明,通過免疫組織化學和免疫電子顯微鏡檢查發現adipophilin表達與WOS存在一致性。25例WOS陽性腫瘤中有24例(96.0%)為adipophilin陽性,而27例WOS陰性腫瘤中只有2例(7.4%)為adipophilin陽性。WOS的存在與adipophilin的免疫組織化學表達之間存在統計學上顯著的相關性(P
因此可以推測上皮內脂滴分布可以分為兩種模式:表面聚積和表面+隱窩聚積。在一種模式中,在表面上皮可觀察到脂滴,而另一種模式則是在表面上皮和後者的隱窩上皮都可觀察到脂滴。在大多數腺瘤中觀察到表面聚積,並且在腺癌中不太常見。然而,在一半的腺癌中觀察到表面及隱窩聚積,並且在腺瘤中更少見。免疫電鏡顯微鏡觀察證實了WOS的不同細胞形態。腺瘤中脂滴的形狀是均勻的,而腺癌中的脂滴形狀則相對不規則。八尾建史報導腺瘤中的WOS在內鏡上是規則和均勻的,而在腺癌中則是不規則和斑點狀。WOS可能是由於形態、上皮內和胞質內密度的差異、腺瘤和腺癌之間脂滴的分布不同所致。



圖3 蘇木精和伊紅染色(A,C)和胃腺瘤中adipophilin(B,D)免疫染色的組織病理學結果。 (A,C)組織病理學發現顯示管狀腺瘤(A:低放大倍數; C:高放大倍數)。 (B,D)adipophilin主要在隱窩之間的頂端部分的腫瘤上皮內檢測到。

圖4 蘇木精和伊紅染色(A,C)和胃腺癌中adipophilin(B,D)免疫染色的組織病理學結果。 (A,C)組織病理學發現顯示良好分化的腺癌(A:低放大倍數; C:高放大倍數)。 在窩間頂端上皮和隱窩上皮(A,B)的表面上皮中的檢測到adipophilin。 (C)和(D)中的雙頭箭頭表示隱窩間部。
WOS與口服脂類食物關係
有報導觀察了89例患者的92例胃上皮腫瘤病變。在ESD手術前給予患者乳化脂肪食物,並使用窄帶成像(M-NBI)放大內鏡對病變進行觀察。攝入乳化脂類食物後WOS密度的增加被定義為陽性脂肪負荷試驗結果。將患者分為以下組:對照組,未給予乳化脂肪;第1組,16小時前給予脂肪食物;第3組,脂肪食物在16和4小時前給葯。在所有組中測定陽性脂肪負荷試驗結果的比例。陽性脂肪負荷試驗結果如下:對照組,9%;第1組,26%;第2組,52%;第3組,78%。第2組和第3組的陽性脂肪負荷試驗結果相對於對照組的比率的增加具有統計學意義(卡方檢驗)。外部攝取脂質增加了WOS密度(即脂滴密度),表明脂質被胃上皮腫瘤吸收。口服攝入外部脂質可促進胃上皮腫瘤中上皮內脂滴的積聚。 魯賓等報導口服脂質(含有乳化脂肪的液體形式)被與腸上皮化生相關的胃黏膜吸收。

白色不透明物質(WOS)分級標度。 WOS密度分類如下(箭頭表示胃上皮腫瘤的分界線):0級,腫瘤內無WOS證據; 1級,在多達三分之一的腫瘤中觀察到WOS; 2級,WOS在超過三分之一但在多達三分之二的腫瘤中觀察到; 3級,WOS在超過三分之二的腫瘤中觀察到。

在脂肪負荷試驗之前和之後用窄帶成像(M-NBI)進行放大內窺鏡檢查的結果。 來自第一內窺鏡檢查的影像顯示在左上方,來自第二內窺鏡檢查的影像顯示在右上方。 微血管結構在左下方用黃線描繪,白色不透明物質(WOS)在右下方用白線描繪。 很明顯,脂肪負荷後WOS密度增加,使血管變得模糊。
WOS與胃內pH相關
白色不透明物質(WOS)的存在是腸上皮化生的內窺鏡標誌物。考慮到WOS的性質是吸收脂滴,脂肪酶在脂質吸收過程中起重要作用,並且在強酸性下失活。 WOS可能僅在幽門螺桿菌感染後存在於胃酸過少的情形,因此可能不是高度敏感的標誌物,尤其是在幽門螺桿菌根除的患者中可能不常見。八尾建史團隊研究了WOS與胃酸條件之間的關係。共有501例患者使用放大窄帶成像回顧性評估了2個感興趣區域的WOS的存在。還測量了收集的胃液的pH水準。研究終點為:(1)WOS患病率及其與胃液pH值的3種關係:幽門螺旋桿菌未感染,幽門螺旋桿菌感染和幽門螺桿菌根除; (2)29例幽門螺桿菌根除患者給予質子泵抑製劑(PPI)前後WOS患病率與胃液pH值的關係。幽門螺桿菌感染的幽門螺桿菌感染組和幽門螺桿菌根除組中WOS的患病率為0(0/206),28.4%(31/109)和3.2%(6/186)。在幽門螺桿菌感染組和幽門螺桿菌根除組中,WOS陽性病例的平均胃液pH顯著高於WOS陰性病例(P



隨著黏膜萎縮程度的進展,胃中的pH值被中和至約7.0的。相反,幽門螺桿菌根除治療有助於胃液pH的正常化,這是由於酸分泌的恢復,不僅在完整的胃中,而且在胃切除術後的剩餘胃中也是如此。然而,一些患有嚴重胃酸過多的患者可能無法恢復,因為他們會進入不可逆的階段。眾所周知,慢性胃酸過少和胃酸缺乏是胃癌發生的重要危險因素。因此,我們急需推測不同胃酸條件下的內鏡觀測指標。WOS表達的機制表明WOS的存在可以是代表由於幽門螺桿菌感染引起的胃內pH中和的標誌。因此,WOS可能是預測胃癌發展的高風險的重要標誌物。
WOS與腸化相關
胃黏膜腸上皮化生(IM)與分化的胃癌風險增加有關。雖然通過內窺鏡診斷IM很重要,但通過白光內窺鏡檢查很難觀察到。在胃的窄帶成像(M-NBI)的放大內窺鏡檢查中,廣泛已知亮藍脊(LBC)是IM的內窺鏡診斷中的有用標記。有研究評估了胃的M-NBI上WOS的存在是否可以像LBC一樣作為IM的標記。受試者為2014年7月至12月期間接受M-NBI的40例連續患者。結果WOS對組織學診斷IM的敏感性和特異性分別為50.0%(95%置信區間[CI] :40.0%~50.0%)和100.0%(95%CI :85.0%~100.0%)。同時,敏感性和特異性LBC分別為62.5%(95%CI :51.1%~65.9%)和93.8%(95%CI :76.7%~98.9%)。 WOS和/或LBC(WOS陽性和LBC陽性,WOS陽性和LBC陰性,或WOS陰性和LBC陽性)對組織學診斷的IM的敏感性和特異性為87.5%(95%CI :76.9%~90.9%)和93.8% (95%CI :77.9%~98.9%)。該研究表明LBC和WOS都是IM內鏡診斷的有用標記。結合兩種標記可提高靈敏度。
白色不透明物質(WOS)陽性的黏膜。 放大內鏡檢查,窄帶成像(M-NBI),顯示在邊緣隱窩上皮(MCE)之間的中間部分存在緻密的WOS,但沒有上皮下毛細血管。 在MCE邊界沒有看到亮藍脊(LBC)。 b蘇木精和曙紅(H&E)染色(放大倍數×20)的組織病理學外觀顯示隱窩上皮內的杯狀細胞,但沒有刷狀緣。 c組織病理學外觀用阿爾新藍高碘酸 - 希夫染色(放大倍數×20)顯示各種大小的杯狀細胞,但沒有刷狀緣。
白色不透明物質(WOS)和亮藍脊(LBC)陽性的黏膜。 放大內窺鏡檢查,窄帶成像(M-NBI)顯示介入部分的WOS,以及邊緣隱窩上皮邊緣的LBC。 b蘇木精和伊紅(H&E)染色(放大倍數×20)的組織病理學外觀,顯示隱窩上皮內的杯狀細胞和部分可見的刷狀緣。 c使用阿爾新藍高碘酸 - 席夫染色(放大倍數×20)的組織病理學外觀,顯示各種大小的杯狀細胞和刷狀緣的一小部分。

在該研究中計算了觀察者間的一致率。 WOS的診斷一致率為95.0%(kappa係數0.89 [優秀]),而LBC的診斷一致率為72.5%(kappa係數0.43 [中度])。當通過M-NBI觀察到非IM黏膜時,邊緣隱窩上皮的邊緣通常帶有白色光澤。對放大內鏡檢查經驗較少的內鏡醫師認為這是一種LBC,這可能導致LBC的診斷一致率較低。同時,WOS的診斷一致率很高,表明其作為指標具有很強的重現性,與內窺鏡檢查經驗無關。此外,WOS的觀察者內一致率為87.5%(kappa係數0.76 [良好至中等]),LBC為75.0%(kappa係數0.44 [中等])。
WOS可鑒別胃腺瘤與腺癌
在0-IIa型胃腫瘤病變的情況下,存在兩種截然不同的組織學類型:腺瘤和癌。在這些病理狀況之間進行鑒別診斷對於內鏡醫師來說是相關的,因為生物學行為因組織學類型而異。八尾建史等發現其規則分布是腺瘤的特徵,而其不規則分布是癌症的特徵。因此,在密集的WOS掩蓋腫瘤病變內的MVP的情況下,WOS的形態可以證明是替代的用以鑒別腺瘤與癌的光學標記。


腺瘤和內鏡切除的腺瘤和癌的標本的NBI和組織病理學結果的ME結果顯示,腺瘤的NBI表明存在密集的WOS,WOS的形態顯示 具有良好組織和對稱分布的常規網狀/迷宮狀圖案(常規WOS)。 B,ME對癌症的NBI的發現表明存在WOS並且WOS的形態顯示出不規則斑點圖案(不規則WOS)的無組織和不對稱分布。 C,對應於圖A的組織病理學發現顯示了管狀腺瘤。 D,對應於圖B的組織病理學發現證明了良好分化的腺癌。
WOS與分化類型、黏液表型的關係
有研究回顧性分析120例患者的130例胃上皮瘤(45例腺瘤和85例早期腺癌)。通過M-NBI評估WOS的存在狀態。通過免疫組織化學染色檢查脂質體的脂質。使用針對CD10,MUC2,MUC5AC和MUC6的抗體,將組織表型免疫組織化學分類為腸(I),胃腸(GI)和胃(G)。根據adipophilin表達對WOS陽性瘤形成的組織學分化和黏蛋白表型進行表徵和檢查。結果發現WOS與腺瘤或分化型腺癌和混合型或未分化型腺癌的組織學差異相關(P=0.0153)。 adipophilin僅在原發性腺瘤和高到中度分化的腺癌組分中表達,但在未分化的組分中不表達。僅在具有腸或胃腸表型的瘤形成中觀察到WOS和adipophilin表達,但在具有胃表型中沒有觀察到(P
八尾建史等的研究也發現腸型的胃腫瘤中的WOS是由脂質的積累引起的,而胃型胃腫瘤未見WOS。
胃腸上皮細胞標誌物





低級別腺瘤,腸道表型為代表性WOS陽性胃腫瘤之一。a.用白光內窺鏡檢查在胃竇處觀察到略帶白色的0-IIa型腫瘤(箭頭)。 b.窄帶成像放大內鏡(M-NBI)顯示常規WOS。 WOS的形態顯示具有規則網狀圖案的良好組織和對稱分布。由於密集的WOS遮蓋了上皮下微血管,因此無法觀察到上皮下微血管模式。 c.切除標本的蘇木精和伊紅染色顯示低級別的管狀腺瘤。 d.adipophilin主要在隱窩之間的介入頂端區域的淺表性腫瘤上皮內檢測到。在腫瘤腺體的腔側檢測到CD10。 f.在腫瘤腺體中瀰漫性檢測到MUC2。 g.腫瘤腺體對MUC5AC呈陰性。上部的非腫瘤上皮顯示陽性焦點表達。 h.腫瘤腺體對MUC6呈陰性。

混合型胃腸道表型的早期腺癌作為代表性WOS陽性胃腫瘤。a.用白光內窺鏡檢查在胃竇處觀察到略微升高的帶紅色的0-IIa型瘤形成。 b.M-NBI結果顯示腫瘤口側有不規則的WOS。 c.切除標本的蘇木精和伊紅染色。腫瘤由黏膜內孔到中度分化的管狀腺癌組分和在低放大倍數下可見的侵入性低分化腺癌組分組成。 d.圖c中方框d的高度放大顯示腫瘤腺體由分化良好的管狀腺癌組成。在該領域,M-NBI檢測到WOS。 e.僅在分化良好的管狀腺癌組分中觀察到陽性adipophilin表達。 f.圖c中框f的高度放大顯示了侵入黏膜下層的低分化腺癌細胞。 g.在低分化的腺癌組分中未檢測到adipohilin表達。
參考文獻
1.Digestive Endoscopy (2012) 24, 419–425.
2.Endoscopy International Open 2015; 03: E597–E604.
3.Endoscopy 2017; 49: 529–535.
4.Digestive Endoscopy 2013; 25: 147–155.
5.Endoscopy International Open 2018; 06: E830–E837.
6.Endosc Int Open 2015; 03: E318–E322.
7.Cancer Sci 2015;106:951–958.
作者:青海濤 來源:消化專家青海濤大夫
關注消化界,每天更精彩!