景傑生物|報導
編者按:乳腺癌是一種重要的常見疾病,是癌症相關死亡的主要原因之一,對女性健康帶來了嚴重的危害。在上個世紀初,所有乳腺惡性腫瘤患者都接受了統一治療。 隨著時間的推移,科學家發現患有相同類型癌症的患者預後不同,對乳腺癌的臨床鑒定和分類工作提出了新的要求。
近日,國際專業學術期刊Cancer Research雜誌上發表了蛋白組學技術運用於乳腺癌分子分型的最新研究成果。以色列特拉維夫大學薩克勒醫學院Tamar Geiger教授通過基於質譜的蛋白質組學分析了130多例乳腺癌樣本,闡述了三種乳腺癌亞型和健康組織之間的腫瘤間異質性。無監督分析確定了四個蛋白質組,其中一個代表一種新的管腔亞型,其特徵是增加的PI3K信號傳導。

研究者使用獨立的基於蛋白質的數據集進一步驗證該亞型(不在兩個獨立的轉錄組群中驗證), 證明了深度蛋白質組學分析的重要性。而這個結果極有可能影響癌症的治療決策。
實驗思路
基於蛋白組學的腫瘤分型策略的一般性思路為:
1、運用高通量蛋白組學分析、生物資訊學分析不同亞型癌症組織樣本與健康組織之間蛋白組差異;
2、分析樣品蛋白組數據與已知癌症亞型的相關性;
3、解析不同分型的樣本的蛋白表達和修飾特徵;
本文中研究人員採集了131例乳腺癌組織樣本,採用高通量蛋白組學分析,結合生物資訊學的技術進行蛋白組分析,一共鑒定到10819個蛋白。使用監督方法分析131個樣品與已知乳腺癌亞型的相關性; 並使用無監督分析揭示新的乳腺癌分類。
研究結果
1. 乳腺癌亞型之間的監督分析比較
為了驗證蛋白質組學數據中已知的亞型特徵,研究者對健康組織和每個亞型之間中已知亞型標記變化進行了分析。這些標記包括ERBB2,MKI67,KRT18,EGFR,CD44和FOXA1。 與ER+和TN相比,HER2樣本中HER2蛋白水準比較高;TNT腫瘤中KRT18和FOXA1顯著降低; 然而,EGFR和CD44僅在TN中略高於其他亞型。 值得注意的是,與健康組織的比較顯示,一些癌症標誌物不僅僅在轉化組織中表達。乳腺癌亞型比較結果顯示,每種亞型中都有數百種重要蛋白質上調錶達。如前所述,通過I型干擾素和抗原呈遞過程驗證的上調的免疫活性在TN腫瘤中顯著富集。為了進一步對樣品進行普遍性的分析,研究者使用了較低嚴格標準的亞型特異性和構建KEGG途徑蛋白質組學圖。
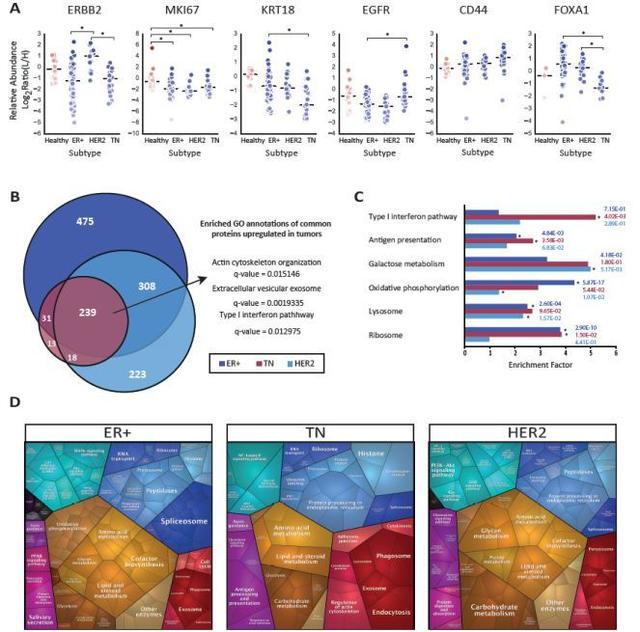
Figure 1 乳腺癌亞型和健康組織的監督分析
2. 癌症蛋白質組的無監督分析確定了四個腫瘤簇
為了更好的顯示亞型之間的差異,研究者排除了22個健康對照,使用共識聚類演算法對109個腫瘤樣品進行了分類。研究者對於腫瘤簇數量進行優化,使聚類效果達到最佳,成功將乳腺癌樣分為四個簇。 共識簇之間的經典亞型分析顯示出了與已知分類的部分一致性。大多數TN樣本屬於共識簇4(Consensus cluster 4); HER2樣本在所有的簇中都有分布; ER+樣品(LumA或LumB)分成了三個簇。雖然CC1,CC2和CC3都與ER+樣本相關聯,CC2和CC3更接近富含TN的簇,CC1跟它們的差異較大。
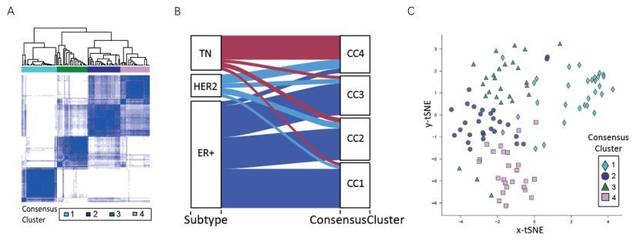
Figure 2 共識聚類鑒定蛋白質組聚類
4.新LumA簇(CC2)的臨床相關性
為了進一步驗證獨立樣本,研究者重新分析了TCGA提供的反相蛋白質陣列(RPPA)數據——這些數據包括對848個腫瘤樣本中217種抗體的檢查。研究者僅選擇了本研究中包含的臨床亞型的IDC樣本(n = 621)。與質譜數據相似的是,TCGA RPPA數據的k均值聚類鑒定到兩個LumA簇。具有四個簇的k均值聚類產生了一個HER2簇,一個基礎簇和兩個富集LumA樣品的簇(其中一個也富集到LumB樣品)。使用可選的五個簇運行相同的演算法給出了類似的結果,但將LumA/LumB簇分成兩個不同的簇。兩個LumA RPPA簇的比較也體現了特定蛋白質的差異,包括PI3K相關蛋白及其磷酸化形式的顯著差異。之前的研究通過無監督分類比較了基因組和蛋白組學的差異,研究者分析了是否能夠通過CC2和CC3中差異表達蛋白的蛋白質組學特徵分離LumA樣品(基於LumA樣品的RNA譜)。與基於蛋白質水準的分離相反,相同基因的RNA數據的分級聚類顯示,即使根據其亞型分類,內在亞型之間沒有明顯的區別。
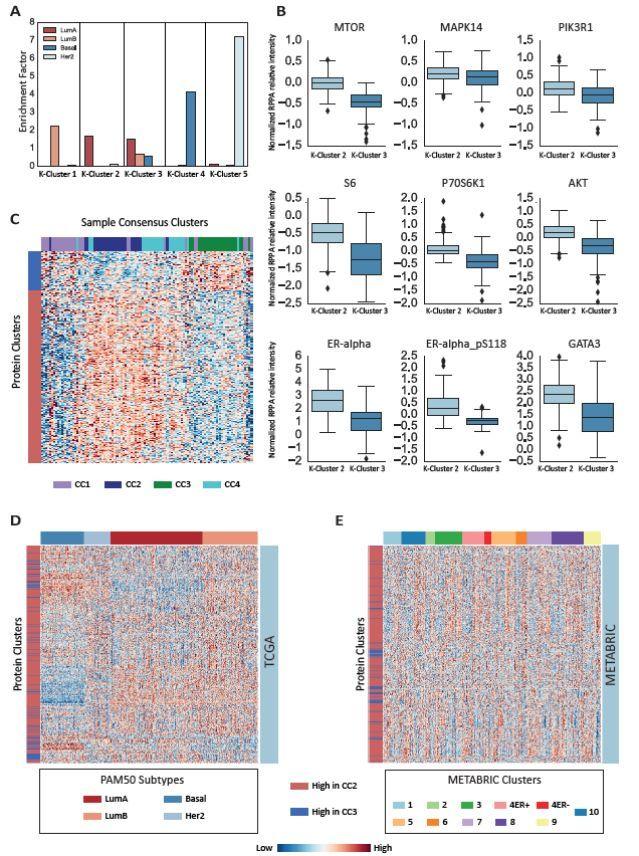
Figure 3 蛋白質組學分類的獨立驗證
小結
本文採用了高通量蛋白組學分析結合質譜和生物資訊學的方法分析了131個乳腺癌樣本,一共鑒定到10819個蛋白,鑒定新的LumA亞型。更重要的是,本研究基於蛋白質組學對管腔乳腺腫瘤進行分類,為更全面的乳腺腫瘤臨床評估奠定基礎,從而有利於治療決策。 因此,這項工作可能代表了對激素治療反應的定向研究的起點。 這類重點研究將包括患者的生存資訊以及有關患者治療過程和反應的臨床數據。
本文作為蛋白質組學在疾病分型與精準治療研究領域的典型運用案例,也體現了蛋白質組學在腫瘤精準治療研究中的重要意義。蛋白質作為功能的最終執行者,其差異變化是導致腫瘤發生的直接原因。基於高靈敏度、高通量的蛋白質組學技術,通過對基因、蛋白質等遺傳資訊多維度、綜合關聯的分析,不但可以從蛋白質層面驗證腫瘤相關的基因突變、可變剪切的真實表達情況,還能夠直接檢測蛋白表達豐度及翻譯後修飾水準的差異,發現上下遊調控分子,從而實現腫瘤的分子分型與精準治療。
蛋白組學在腫瘤分子分型領域主要的運用有:
1、分子分型與生物標記物:使用基於蛋白質組學的方法對腫瘤臨床大樣本進行檢測,分析更貼近疾病表型的分子分型,尋找代表性的生物標誌物;
2、藥物精準開發:解析不同分型的樣本的蛋白表達和修飾特徵,尋找新的藥物靶點和治療方法,
3、腫瘤發生機理:以蛋白質組分析結果為核心,同基因組、轉錄組和代謝組等其他維度的數據做關聯分析,多維度解析腫瘤發生髮展過程的全貌。
精準醫學與蛋白組學
海量文獻解讀
行業前沿報導
關注/投稿
隨時享受科技服務