通過藥物來直接靶向B肝病毒複製模板cccDNA,已經成為慢B肝研究領域長遠目標。最近,美國馬裡蘭大學醫學院將豬心髒成功地移植到患者體內,使用到了基因編輯技術,這項全球首例豬心髒移植也有賴於基因編輯這項技術。

B肝cccDNA抑製劑開發,可直接靶向cccDNA,當前潛在藥物僅有一種
一、豬心成功移植——歸功於基因編輯技術敲除排異基因
回顧以往想要攻克豬心移植到人體,就需要解決免疫排斥的問題。在最近這些成功案例中,科研人員使用基因編輯技術敲除了3個可能導致免疫排異的基因和1個會讓豬心髒繼續生長的基因,並植入了6個使豬心理想地適應人體免疫的基因,解決了免疫排異問題。
雖然,這項成功移植案例才剛過去一周,這名受試者的後續健康狀況尚有待進一步的觀察,但我們應當已對基因編輯技術產生了濃厚的興趣,這項技術在慢B肝 研究領域有哪些進展?還有哪些開發前景?

二、在慢B肝新藥開發中,基因編輯將有哪些貢獻?
帶著上述問題,我們聊聊cccDNA抑製劑,這是目前科研人員採用三種常規基因編輯技術包括鋅指核酸酶 (ZFN)、轉錄激活因子樣效應核酸酶 (TALEN) 和成簇的規則間隔短回文重複序列 (CRISPR/Cas9) ,來研究B肝藥物開發。
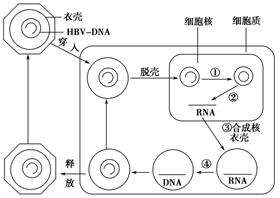
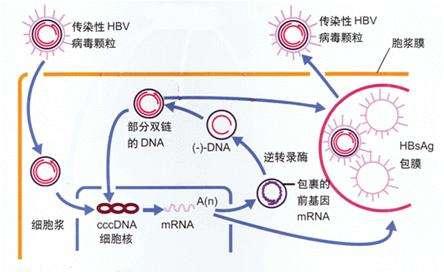
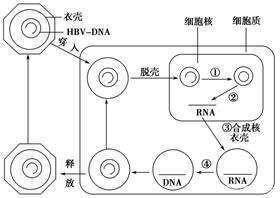
這項技術的特點是能夠直接作用cccDNA,可將其歸類為核酸內切酶,因此將採用上述醫藥技術開發出來的後續藥物統稱為cccDNA抑製劑。這三種常規的基因編輯技術是三種DNA切割酶模塊,可用於製造雙鏈斷裂 (DSB)。cccDNA是一種共價閉合環狀的雙鏈DNA,可以成為比較理想的靶標。這些製造雙鏈斷裂使用易出錯的非同源末端連接(NHEJ)途徑或無錯誤的同源重組途徑進行修複。
非同源末端連接的通路可能會產生具有插入、缺失、框內或移碼突變的無功能cccDNA。基於上述醫藥技術開發的化合物,都暫時處在早期研究階段。ZFN和TALEN這兩項我們暫且不提,先介紹CRISPR/Cas9。CRISPR/Cas9技術,是由2020年獲得諾貝爾化學獎的兩位女科學家發現的(法國科學家埃瑪紐埃爾·沙爾龐捷和美國科學家珍妮弗·杜德納),這也是一種全球最新的基因編輯技術。
目前,基於CRISPR/Cas9的候選藥物都還在臨床前廣泛評估中。它使用合成的單向導鏈RNA(sgRNA)在它針對的任何位點用其核酸酶Cas9來切割DNA。相比於以往的基因編輯方法ZFN和TALENS,CRISPR/Cas9在開發出更高功效的候選藥物方面具有潛力。
來自:Precision公司新藥研發管道,可見基因編輯候選藥物PBGENE-HBV

三、基因編輯特點:直接針對cccDNA,全球暫時只有一種候選藥物
cccDNA,它是B肝病毒複製的根,充當著新病毒粒子的模板。因此,從這個方向考慮,如果cccDNA的產生受到抑製,就可能為慢性B肝患者帶來新的治療選擇。一些小分子已經表現出能夠阻斷cccDNA形成或沉默cccDNA轉錄,其中就包含切割序列特異性DNA靶標和採用成簇規則間隔短回文重複系統(CRISPR/Cas9)來基因編輯。
小番健康結語:目前,採用基因編輯來直接靶向cccDNA的暫時只有候選藥物PBGENE-HBV。這是一款由Precision BioSciences公司使用ARCUS基因編輯平台開發的慢B肝在研新藥,正處在臨床前階段,預計在2024年提交新藥臨床試驗申請,就是有望於2024年啟動1期臨床研究。
這款在研B肝新藥主要表現在降解cccDNA方面具有潛力,正如,最近採用基因編輯來敲除排異基因的豬心髒成功移植案例,基因編輯技術用於開發cccDNA抑製劑還需要進一步觀察。返回搜狐,查看更多
責任編輯: