[關鍵詞] 藥品標準; 技術創新;專利;創新技術標準戰略
電子通信屬於專利密集型行業,需要通過協定標準來提升專利技術的市場價值,並通過專利的交叉許可獲得行業準入。標準必要專利和FRAND原則為電子通信領域的熱點詞。但是,以藥品標準作為上市準入制度的醫藥行業卻長時間忽視標準必要專利的戰略推進。本文擬從藥品標準的角度重新審視醫藥專利保護策略,對醫藥創新主體實施創新技術標準戰略,圍繞核心產品專利進行戰略布局,釋放提升創新技術價值提供更多思路。
1 我國藥品標準的歷史沿革與發展趨勢
《中華人民共和國藥品管理法》(2015年4月24日修訂)第32條規定,除中藥飲片外,藥品必須符合國家藥品標準。國務院藥品監督管理部門頒布的《中華人民共和國藥典》和藥品標準為國家藥品標準。國務院藥品監督管理部門組織藥典委員會,負責國家藥品標準的制定和修訂。《中華人民共和國標準化法》(2015年7月15日修訂,下稱《標準化法》)第七條規定:國家標準、行業標準分為強製性標準和推薦性標準。保障人體健康、人身、財產安全的標準和法律、行政法規規定強製執行的標準是強製性標準,其他標準是推薦性標準。《標準化法》第十四條規定:強製性標準,必須執行。不符合強製性標準的產品,禁止生產、銷售和進口。可見,國家藥品標準屬於強製性標準,由國家食品藥品監督管理總局(CFDA)頒布,為全國製藥企業及相關部門在生產、經營及管理等工作中必須遵循的規範,其內容包括品質指標、檢驗方法以及生產工藝等技術要求。
我國自1978年實施藥品標準制度以來,隨著醫藥產業技術的更新換代,國家對藥品標準與藥品品質的要求逐步提高,藥品標準管理正經歷著從未成體系到逐步成體系的變革過程。國家藥品標準包括由地方藥品標準(下稱地標)更新而來的國家藥品標準(下稱國標)、部頒藥品標準和《中國藥典》。
1978年至1984年間,我國藥品標準經歷了「國家標準→衛生部標準→地方標準→國家藥品標準和地方藥品標準」的過程。為與該項改革工作配合協調一致和強化中成藥標準管理工作,國家藥品監督管理局在2001-2002年間彙編了《國家中成藥標準彙編-中成藥地方標準上升為國家標準(1~13冊)》,並對公眾公開發行和出售彙編本[1]。部頒藥品標準在多個形成環節中以不同形式出現,進而表現為彙編成冊的部頒標準、未成冊的正式標準頒布件和試行標準頒布件。
《中華人民共和國藥典》為國家藥品標準體系的核心和保障藥品安全的最低標準,是監督檢驗藥品品質的技術法典和技術規範,是藥品生產、經營、使用和管理者都必須嚴格遵從的規定,更是藥品標準國際交流的平台。為了準確及時更新臨床藥品的使用和生產標準,保障臨床藥物的有效性和安全性,國務院藥品監督管理部門組織藥典委員會,負責國家藥品標準的制定和修訂,定期頒布《中華人民共和國藥典》。自建國以來,我國先後頒布了十版藥典,並根據需要頒布增補版。
2 國家藥品標準提升中的技術創新與專利保護
在國家藥品標準的變革中,需要技術創新來推動藥品標準的更新發展,並出現了很多應用專利保護藥品標準的典型案例。
2.1地標升國標中的技術創新與專利保護
地標升國標期間,一些納入國家藥品標準的地標藥物品種在變更中提升了藥品品質與標準,為保障人類健康做出了巨大貢獻。一些專利保護意識較強的企業將改進的創新成果或地標品種本身提交專利申請。國家專利行政部門早期難以檢索獲得藥品標準的公開資訊,使得部分未作品質提升的品種限於檢索手段而被不當地授予專利權。已有部分地標升國標的品種獲得專利保護。隨後,專利權人利用專利武器攔截其他醫藥企業生產銷售而引發專利侵權糾紛。部分國內醫藥企業在仿製已有國家標準的地標升國標品種時,由於忽略相關品種的專利,會面臨專利權人發出的侵權警告或提起的侵權訴訟。根據國家知識產權局專利複審委員會的不完全統計,目前涉及地標升國標的專利無效案件多達40餘件,這些無效案件的背後一般都伴隨專利侵權之訴。例如,邕江葯業公司與河南天工公司之間圍繞第ZL95109783.0號專利的侵權糾紛案件、康國忠與亞東公司圍繞第ZL02134100.1號專利的侵權糾紛案件等,都屬於這種情況。
2.2改進檢測方法,控制藥品品質的技術創新
為了檢驗藥品的內在品質,需要專屬性強、精確度高、靈敏度好的專用分析檢驗方法。一些醫藥研發人員通過將其對於藥品檢測的創新成果提交專利保護,再將創新專利技術融入國家藥品標準,利用藥品標準的強製性,藉助藥品標準專利權攔截仿製者,進而藉助技術優勢和專利優勢維護其市場獨佔地位,保障其投資收益。例如,雲南白藥集團採用創新的辛烷基矽膠鍵和相色譜柱的分析測定方法完成宮血寧膠囊的品質控制,在獲得專利權保護(ZL02113815.X)後,將其專利技術融入《中華人民共和國藥典》(2005年版)進一步強化保護,其專利保護策略值得借鑒[2]。
2.3有關控制原料葯雜質的技術創新
為了最大限度地降低可能由雜質毒性導致的研發失敗風險,醫藥研發人員通常會致力於追求高純度的原料葯。在此過程中,可能產生的發明創造包括:①首次合成、分離並表徵現有技術尚未提及的原料葯中的新雜質。②將已知雜質控制在藥物可接受的雜質含量範圍之內。20世紀60年代,反應停由於孕婦服用後產生海豹胎而被迫退市。英國科學家發現反應停的致畸作用為其S-異構體。通過分離純化技術去除消旋體中的S-異構體,並發現R-異構體具有良好的鎮靜作用,且能夠抑製腫瘤血管生長,對癌細胞有免疫刺激作用。FDA於1998年批準反應停的R-異構體用於治療麻風性結節性紅斑,並於2006年批準其用於治療多發性骨髓瘤。
3 醫藥創新技術標準戰略
3.1醫藥產業的創新發展需要對其創新成果給予知識產權強保護
縱觀國內外發展實踐,醫藥產業的創新發展得益於知識產權的強保護。加強醫藥產業的知識產權保護,利於激發創新主體的創新活力,提升其競爭實力,大力推進醫藥產業的持續健康發展,為大眾用藥安全提供更為豐富的醫療保障,具有十分重要的現實意義。醫藥產業要繼續保持創新優勢,就必須鼓勵創新者合理利用知識產權規則,逐步實現「創仿結合→自主研發→國際化」的戰略轉變,積極搶佔新一輪發展制高點。同時,根據發展需要,逐步完善知識產權保護體系,切實加大保護力度,從根本上激勵創新主體提升創新能力,加快培育並迅速壯大醫藥產業,滿足大眾日益增長的健康需求,實現醫藥產業創新發展的良性循環[3]。
3.2以制度創新為手段,推動藥品標準與藥品專利的協同發展
我國醫藥產業將逐步從資本主導的法律規範時代向知識主導的技術標準時代轉變。技術標準戰略將成為創新主體實現創新驅動發展戰略的必然選擇。在合理協調二者衝突的基礎上,藥品標準與藥品專利必將呈現有機融合、相互促進、協同發展的狀態。
專利技術代表著創新技術的發展方向。藥品品質標準的提高離不開創新專利技術的引入,如新的化合物、新的藥物晶型、新的檢測方法、新的製藥用途等。將創新專利技術融入藥品標準,對提高藥品品質並確保用藥安全大有裨益。傳統優勢品種要持續提高標準,新品種的知識產權要融入標準,專利保護期限屆滿品種要提前更新標準,已成為業界共識[4]。
3.3全面提升國家藥品標準是我國醫藥產業走向國際化的發展需求
我國是全球醫藥資源最為豐富的國家。國外製葯企業利用技術研發優勢,解析我國中藥配方及製劑,並對相關研發成果加以知識產權保護,再將創新專利技術融入藥品品質標準中,為我國中醫藥創新發展設定了很多知識產權陷阱和技術壁壘[5]。
我國中醫藥要實現國際化,必須吸納改進創新技術,提高藥品品質與標準,並逐步實現與國際接軌,逐步向全球推行國際公認的現代中藥標準。例如,康緣葯業圍繞桂枝茯苓布局了11件專利申請,並將創新專利技術融入國家藥品標準,再借力國家藥品標準與專利布局優勢維護並鞏固其市場競爭優勢。產品未動,專利先行。為了配合其進軍美國市場的發展戰略,康緣葯業還圍繞桂枝茯苓技術提交了3件PCT申請,保護主題涉及藥物組合物、藥物製劑、指紋圖譜、質控方法、製備方法、加味等藥品標準相關的創新技術,並先後在中國、美國、歐洲、日本、韓國等國家和地區進行專利布局,形成較為完備的知識產權保護體系,為其進軍海外市場進行知識產權儲備。
3.4醫藥創新技術標準戰略的實施路徑
為了保障上市藥品的有效性、安全性與品質可控達到或接近國際先進水準,國家部署了系列行之有效的舉措。一是逐步統一藥品標準體系;二是推進仿製葯品質和療效一致性評價,逐步提高藥品的品質和療效並推進國際化。中國醫藥產業要在國際競爭中佔據有利位置,必須實施走出去的戰略,並實現藥品標準和品質與國際接軌,利用科技創新為其提供技術保障。
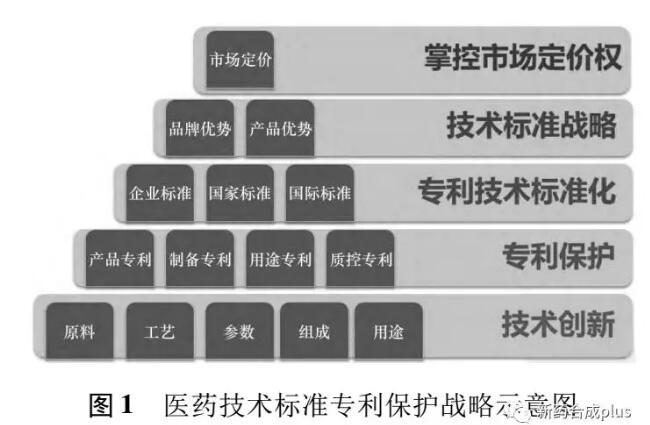
實施藥品創新技術的專利標準戰略,將圍繞提高藥品品質和標準引進系列創新技術,如新的製劑、藥物組合、藥物晶型、製藥用途與製備方法等,再將創新改進成果提交專利申請給予保護,並戰略考量「技術、時間、地域」等維度,實現「數量布局、品質取勝」的專利戰略組合,合理利用知識產權規則實現創新成果的強保護,實施創新技術的專利化,保障創新投資收益。再將創新專利技術融入藥品標準,實現專利技術的標準化,藉助技術標準推廣專利創新技術的應用,釋放提升創新專利技術價值,實現創新利益的最大化(見圖1)。藥品標準中引入引領技術創新的專利技術、藥品標準中融合專利技術必將成為推動醫藥行業快速發展的必然。

4小結
世界貿易組織貿易技術壁壘協定(WTO/TBT)指出:「國際標準和符合性評定體系能為提高生產效率和便利國際貿易做出重大貢獻」。隨著醫藥產業的迅猛發展,藥品品質和安全備受各國高度關注,藥品標準在國際貿易中的技術橋樑作用日益凸顯,並成為跨國企業參與競爭的有力武器。藥品標準是各國醫藥主體必須遵守的技術規範。標準制定者要利用政策引領的槓桿效應,加大支持藥品標準專利對技術創新的激勵作用,並通過有效的程式和方法推進醫藥創新發展。醫藥創新主體可以利用產品上市的標準制度,對藥品品質標準研發過程中的創新成果予以專利保護,並藉助於藥品標準對醫藥主體的規範使用,強化其創新成果的專利保護,並應用專利維護和拓展自身的市場份額。就我國的醫藥產業而言,創建集標準的市場統一作用與專利的排他作用為一體、有機整合專利技術和標準戰略的醫藥技術標準戰略,是值得積極探索的創新發展之路[6]。
[參考文獻]
[1]鄧聲菊,何黎清.地標升國標對藥品能否獲得專利保護的探討[J].中國發明與專利,2008(8):63-64.
[2]國家藥典委員會.中華人民共和國藥典[S].北京:中國醫藥科技出版社,2005:549.
[3]張蓓.藥品標準與專利相關問題研究[D].北京:北京中醫藥大學,2010.
[4]江蘇省連雲港市中級人民法院.關於連雲港地區醫藥產業知識產權司法保護狀況的調研報告[EB/OL].[2015-07-10].http://www.lygfy.gov.cn/sfdy/2015/07/10083832635.html
[5]楊海東.中藥的標準化和專利保護問題初探[J].科技與法律,2004(3):103-106.
[6]楊巨集軍.論中藥專利保護中的標準戰略[D].北京:北京大學,2004.
本文來源:Chinese Journal of New Drugs[J].2018(05):494-497
本文作者:吳 斌1,苗彥妮2,彭曉琦3,林光美4,鄧聲菊1(1 北京四環製藥有限公司,北京 100025; 2 國家知識產權局專利局醫藥生物發明審查部,北京 100088;3 國家知識產權局專利局專利審查協作北京中心,北京 100081; 4 清遠市科學技術局,清遠 511500)
葯融圈版權聲明:本文轉自新葯合成plus,如不希望被轉載的媒體或個人可與我們聯繫,我們將立即刪除
歡迎關注葯融圈官網
TAG: |