大家好,這裡是漢靚的醫藥科技前沿的第39期! 之前的節目中,我已經提到,希望在這個平台上可以定期發布一些行業深度報告,頻率大概是一個季度一篇,在第34期節目,也就是三月底的時候,我推出了在這個平台上的第一篇行業深度報告《二代基因測序在癌症領域的應用和發展前景》。本期節目結合了之前在公眾號陸續發表的相關文章,包括介紹過的基因治療行業的領先公司Bluebird, Spark,還有AveXis等等,整理成本期的行業深度報告《基因治療:從癌症到罕見遺傳病》。
報告摘要:
從上世紀90年代興起的基因治療,經歷了20多年的起伏,又重新受到廣泛關注。2017年,伴隨著兩款CAR-T療法和Spark公司的基因治療產品在美國獲批,更被認為是「基因治療」之年。本文將通過以下內容,詳細介紹基因治療在全球範圍內的進展和前景:
第一部分:介紹基因治療的定義、發展歷程、主要的分類,包括體內和體外基因療法;
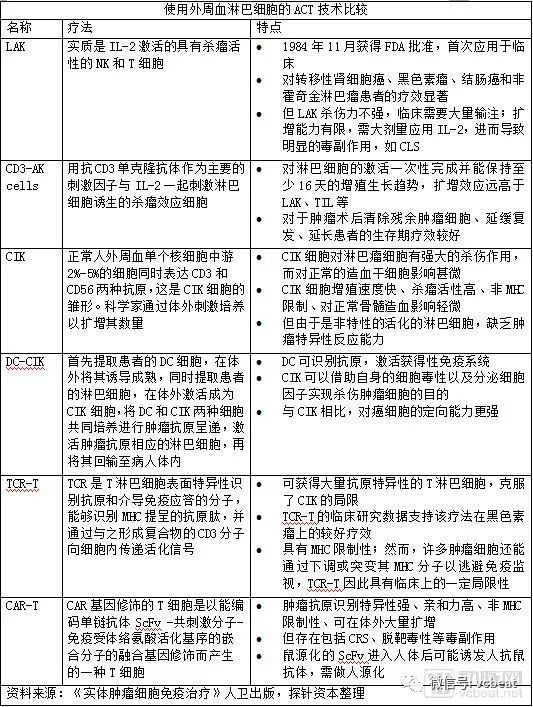
第二部分:詳細介紹基因治療在腫瘤領域的應用,主要是通過體外基因改造、培養T細胞,以CAR-T或TCR-T的形式,重新回輸到體內,攻擊癌細胞。CAR-T技術目前相對成熟,領先公司包括諾華、Kite等;TCR-T在實力瘤領域被寄予厚望,代表公司有Adaptimmune Therapeutics、Medigene等;
第三部分:詳細介紹基因治療在罕見遺傳病領域的進展,除了已獲批的Luxturna,其他領先的基因治療產品包括:BioMarin針對血友病A的BMN270,AveXis針對脊髓型肌肉萎縮症的AVXS-101等;
第四部分:展示了我國基因治療發展現狀,CAR-T技術關注度最高,多家公司致力於該技術的研發,代表公司有南京傳奇、恆潤達生、科濟生物、博生吉等。基因治療在罕見病領域的應用,由於我國政策、醫保覆蓋等原因,還處在比較早期的階段。
第五部分:展望未來,基因治療作為一種新興的生物科學技術,尤其是伴隨著基因編輯技術的興起,給癌症以及罕見病患者帶來了新的希望。在我國,面對著競爭日趨激烈的CAR-T領域,創始人背景、科研實力、技術路徑、靶點的選擇、CAR-T的品質控制、工藝的穩定性等多方面因素將決定未來誰有可能勝出。
目錄
一、基因治療的發展歷程和分類
1.1基因治療近三十年的發展歷程:從興起,低潮再到重新崛起
1.2基因編輯技術的進步助力基因治療
1.3基因治療的分類
二、基因治療在癌症領域的主要應用:CAR-T和TCR-T
2.1 CAR-T:腫瘤免疫治療的熱門技術
2.2 CAR-T療法的代表公司:諾華
2.3 TCR-T:有望在實體瘤領域突破的腫瘤免疫療法
2.4 TCR-T的代表公司:Adaptimmune Therapeutics
三、基因治療在罕見病領域的應用:眼科、血友病、神經遺傳性疾病等
3.1基因治療在眼科領域的應用,代表公司Spark
3.2基因治療在血友病領域的應用,代表公司:BioMarin
3.3基因治療在神經遺傳性疾病的應用,以及代表公司AveXis
3.4基因治療在其他罕見遺傳病領域的應用
四、我國基因治療領域的發展
4.1 Car-T:我國基因治療的熱門領域
4.2我國基因治療在罕見病領域:起步較晚、進展較慢
五、總結和未來展望
一、基因治療的發展歷程和分類
1.1基因治療近三十年的發展歷程:從興起,低潮再到重新崛起基因治療:廣義的基因治療包括所有糾正、修復DNA缺陷的方法,從而達到疾病治療的目的。早在上世紀90年代,科學家們已開始這樣的嘗試。上世紀90年代,四歲的阿香提患有重症聯合免疫缺陷病(SCID),這是一種因為腺苷脫氨酶的基因缺陷導致的免疫系統幾乎崩潰的罕見遺傳病。美國的安德森醫生和其他合作者,從阿香提體內提取白細胞,將正常的腺苷脫氨酶導入這些細胞,然後把基因改造後的白細胞重新輸入病人體內,手術後的阿香提體內生產出了正常的腺苷脫氨酶。
阿香提的成功案例點燃了人們對於基因治療的熱情,之後多個國家多個科學家迅速投入到基因治療的浪潮之中,很多人認為基因治療的時代已經來臨,一直到1999年,18歲的傑西在一項基因治療臨床試驗中因為病毒載體引起的劇烈免疫反應不幸去世,給科學家們敲響了警鐘,讓人們重新審視基因治療這項技術。
在此之後,基因治療又出現了幾例臨床試驗的失敗,這些失敗讓基因治療陷入了低潮期。一直到最近幾年病毒載體安全性和有效性的不斷改進,基因編輯技術的興起等,基因治療熱度漸升。
2017年,更是被認為是基因治療的突破之年,在這一年,兩款CAR-T產品問世,同時來自Spark公司的具有跨時代意義的眼部罕見病基因治療產品Luxturna獲批在美國上市。從全球範圍來看,目前獲批的基因治療產品主要有以下:
| 癌症領域 | |||||
| Kymriah | 諾華 | 2017 | 美國 | 1)B細胞前體急性淋巴性白血病(ALL);2)複發或者難治大B細胞淋巴瘤 | |
| Yescarta | Kite(現已被Gilead收購) | 2017 | 美國 | 複發 / 難治性大 B 細胞淋巴瘤 | |
| Imlygic | 安進 | 2015 | 美國 | 黑色素瘤 | |
| Rexin-G | Epeius | 2007 | 菲律賓 | 實體瘤 | |
| Oncorine | 上海三維生物技術有限公司 | 2005 | 中國 | 鼻咽喉 &頭頸癌症 | |
| Gendicine | 深圳賽百諾基因技術有限公司 | 2004 | 中國 | 頭頸癌症 | |
| 非癌症領域 | |||||
| Luxturna | Spark Therapeutics | 2017 | 美國 | RPE65基因突變相關的眼部罕見病 | |
| Glybera | uniQure & Chiesi | 2015 | 德國 | 脂蛋白脂酶缺乏症 | |
| Neovasculgen | Human Stem Cell Institute | 2012 | 俄羅斯 | 末梢血管病& 肢體缺血 | |
資料來源:Pharmaprojects;註:歐盟把Imlygic列為一款基因治療產品,但是美國FDA不認為這是一款基因治療產品
圖1:1995-2016年積極開發的基因治療項目的數量

資料來源:Pharmaprojects(June 2016)
圖1展示了1995年-2016年之間全球積極開發的基因治療項目的數量,從2012年左右,積極開發的基因治療的項目數量呈指數級提升,並在2016年達到了約500例,由此可見基因治療行業經歷了寒冬逐漸迎來曙光,並且發展迅速。
1.2基因編輯技術的進步助力基因治療
基因編輯技術的突破也在一定程度上力推基因治療的發展,其中人工核酸內切酶介導的基因組編輯技術,主要包括三種:ZFNs、TALENs和CRISPR/Cas9技術。和傳統基因工程中的病毒載體相比,基因編輯技術提供了一個精準的「手術刀」進行基因的增加,減少以及修改。尤其是以CRISPR/Cas9技術為核心的三大基因編輯公司:Editas Medicine,CRISPR Therapeutics和Intellia Therapeutics,陸續登陸美股,且這三大基因編輯公司均致力於基因治療產品的研發,雖然目前還是在非常早期的階段,但是給基因治療未來的發展帶來很多希望。
表2:美國主要基因編輯公司介紹
| 公司名稱 | 基因編輯技術路徑 | 公司市值(億美金) | 旗下進展領先的基因治療產品 | 研發進展 | 治療領域 |
| Editas Medicine | CRISPR/Cas9 | 18.7 | EDIT-101 | 臨床前 | 眼部罕見病LCA10 |
| CRISPR Therapeutics | CRISPR/Cas9 | 29.6 | CTX001 | 臨床I/II期 | β型地中海貧血 |
| Intellia Therapeutics | CRISPR/Cas9 | 12.5 | ATTR Program | 臨床試驗申請 | 甲狀腺素運載蛋白澱粉樣變性 |
| Sangamo Therapeutics | ZFNs | 16.8 | SB-FIX | I/II期臨床試驗階段 | B型血友病 |
資料來源:Editas Medicine,CRISPR Therapeutics和Intellia Therapeutics公司公告;註:截止日期20180622
1.3基因治療的分類基因治療按照治療方式,主要分為兩大類:
1)體內基因治療(In Vivo Gene Therapy):直接向血液或者目標器官中注射攜帶所需基因的載體。例如,Spark公司的Luxturna屬於該類型;
2)體外基因治療(Ex Vivo GeneTherapy):把患者的細胞從體內移出,通過在體外對於細胞進行基因改造,重新輸入至患者的體內,例如體外基因改造對造血乾細胞,以Bluebird在研的用於治療鐮刀型貧血症的基因治療產品LentiGlobin為代表,或者對免疫T細胞的基因改造,包括CAR-T,TCR-T等。
基因治療按照治療領域分類,又可以細分為癌症,單基因罕見遺傳病,心血管疾病,傳染病等。同時根據Pharmaprojects在2016年的報告,癌症和罕見病是當前基因治療臨床研究最多的兩個領域,如下內容將詳細介紹這兩個領域的基因治療現狀和前景。
圖2:在研的基因治療數量(按照疾病分類)

資料來源:Pharmaprojects(June 2016)
目前基因治療在腫瘤領域的應用,主要是通過在體外基因改造T細胞,通過CAR-T或者TCR-T的形式,再把基因改造後的T細胞回輸到患者體內,讓改造後的T細胞攻擊癌細胞,從而達到治療腫瘤的目的。
2.1 CAR-T:腫瘤免疫治療的熱門技術
CAR-T(ChimericAntigen Receptor T-Cell),中文全稱叫做嵌合抗原受體T細胞。簡單地說,是通過基因改造技術,在T細胞(人體內一種重要的免疫細胞)上加入一個嵌合抗原受體,其主要是由胞外抗原結合區、跨膜鏈接區和胞內信號區三個部分組合,從而讓免疫T細胞不僅能夠特異性地識別癌症細胞,同時可以激活T細胞殺死癌症細胞。CAR-T技術治療癌症的過程,主要是四個步驟:1)T細胞的收集、活化;2) T細胞的體外基因轉導:通過基因工程技術,讓CAR嵌合到T細胞上;3)構建好的CAR-T細胞的體外增值培養;4)CAR-T的回輸和患者的觀測。
圖3:CAR-T細胞治療流程

資料來源:National Cancer Institute
儘管CAR-T的理論由來已久,上個世紀90年代就有科學家提出,但是在過去的幾年中,CAR-T技術突飛猛進,尤其是在2017年美國FDA批準了兩款CAR-T治療方案,分別是來自諾華和Kite(現在已經被Gilead收購)的Kymriah和Yescarta(如表1),除此之外,全球還有多家公司致力於CAR-T領域,代表公司包括:Juno(現已被Celgene收購)、Bluebird、Cellectis等。
2.2 CAR-T療法的代表公司:諾華早在1999年, Dr. Carl June和其團隊在賓夕法尼亞大學已展開CAR-T研究。經過了十幾年的努力,2012年,諾華宣布和和賓夕法尼亞大學合作,共同研發和商業化CAR-T免疫療法,其中就包括了CTL019:一款以CD19為靶點的CAR-T腫瘤免疫療法。同時在2012年,患有急性淋巴細胞白血病的美國7歲女孩艾米麗接受該CAR-T療法,成為了世界上首個接受CTL019治療的患者,艾米麗的癌症至今也沒有再複發。
2017年8月,諾華宣布CTL019(商品名:Kymriah)獲FDA批準用於25歲以下難治或者複發的B-細胞急性淋巴細胞白血病,也是全球第一款獲批上市的CAR-T,其獲批主要是基於一項全球臨床多中心關鍵性臨床試驗數據(ELIANA Study)。
2018年1月,諾華更新了該試驗數據。結果顯示,對於接受CAR-T治療的75名患者,在這之後的三個月或者更長時間的隨訪中,Kymriah展現出了整體的總緩解率達到81%。60%的患者達到了完全緩解(CompleteResponse, CR),同時21%的患者達到了CR,但血細胞計數恢復不完全。對於所有應答患者,沒有檢測出微小殘留病,中位的隨訪時間是13.1個月。
2018年5月,諾華批準了Kymriah用於成人複發或者難治的大B細胞淋巴瘤,包括了非瀰漫性大B細胞淋巴瘤,以及高度的B細胞淋巴瘤。
2.3 TCR-T:有望在實體瘤領域突破的腫瘤免疫療法TCR-T(T cell receptor-geneengineered T cells,TCR-T),中文全稱是T細胞受體基因工程改造T細胞:通過基因工程的手段,直接改造T細胞識別腫瘤抗原的表面受體:TCR(T cell receptor:T細胞受體),從而加強T細胞識別和殺傷腫瘤細胞的能力。
儘管和CAR-T療法一樣,同屬於腫瘤免疫治療,也同樣是體外對T細胞進行基因改造的基因治療。但是和CAR-T療法不同的地方在於:1)CAR-T療法是在T細胞上構建一個嵌合型抗體受體,而TCR-T技術是改造T細胞的表面受體,增強其親和性;2)和CAR-T只能識別腫瘤細胞表面抗原不同,TCR-T可以靶向細胞內或者細胞表面的腫瘤抗原,從而讓TCR-T有了更多的靶點可供選擇,尤其包括多個和癌症相關的細胞內抗原,這也是部分學者認為TCR-T在實力瘤領域具備巨大潛力的原因。
例如,腫瘤-睾丸抗原(Cancer-testis Antigen,簡稱CTAs),是一類發現於多種腫瘤組織內,但是正常細胞內較少出現的細胞質蛋白,被認為和很多癌症息息相關,而這一類的抗原,也成為了目前多款TCR-T療法的目標靶點,包括NY-ESO-1, MAGE A4, MAGE A10等。
圖4:TCR-T和CAR-T的區別

資料來源:Adaptimmune Therapeutics
當然,TCR-T療法目前還存在不少挑戰,尚未有一款產品獲批,面對的困難包括:腫瘤微環境的抑製作用,脫靶毒性、神經毒性,以及和CAR-T治療遇到的類似的CRS(細胞因子釋放綜合征)等等。目前積極從事TCR-T療法開發的公司包括Adaptimmune、Medigene、Kite等。
Adaptimmune Therapeutics是英國的一家生物醫藥公司,成立於2014年,2015年登陸美國納斯達克。公司的核心技術是其特有的TCR-T技術平台:SPEAR(Specific Peptide Enhanced Affinity Receptor)T細胞技術,可以對特定抗原增強T細胞親和力,該技術平台的研發已有超過15年的歷史。
圖5:TCR-T療法的步驟

資料來源:Medigene
以該技術平台為基礎,公司旗下有四款TCR-T治療產品在臨床階段,分別以MAGE-A10, MAGE-A4, AFP 和 NY-ESO為靶點,涉足多個腫瘤類型,包括實體瘤和血液瘤。進度最領先的一款TCR-T療法:NY-ESO TCR,已在多個癌症領域中進行臨床試驗,包括血液瘤領域的多發性骨髓瘤,實體瘤領域裡的黑色素瘤,卵巢癌,非小細胞肺癌,滑膜肉瘤等。不過根據之前的條款,這款產品的全球權利已經授權給GSK。
| MAGE-A10 TCR | 非小細胞肺癌 | 臨床I期 |
| 膀胱、黑素瘤、頭頸癌症 | 臨床I期 | |
| AFP TCR | 肝細胞癌症 | 臨床I期 |
| MAGE-A4 TCR | 多個不同類型癌症 | 臨床I期 |
| NY-ESO TCR | 滑膜肉瘤 | 臨床II期 |
| 黏液樣脂肪肉瘤 | 臨床I期 | |
| 多發性骨髓瘤 | 臨床II期 | |
| 卵巢癌 | 臨床I期 | |
| 黑素瘤 | 臨床II期 | |
| 非小細胞肺癌 | 臨床I期 | |
| 研究者發起的研究,國家癌症研究所,方向:滑膜肉瘤、骨髓瘤 | 臨床II期 | |
| 研究者發起的研究,方向:食道癌 | 臨床I期 |
資料來源:Adaptimmune官網
全球確認的罕見病大約有7000多種,但僅有幾百種罕見病擁有獲批的治療藥物,基因治療在罕見病領域意義重大,因為超過80%的罕見病是由單基因缺陷引起(資料來源:NIH)。對於罕見病,傳統小分子藥物,通常是通過減輕癥狀而發揮作用,與此相反,基因治療擁有糾正基因缺陷的潛能,尤其對於單基因罕見病,提供一個潛在的治癒方案,而不是簡單的管理癥狀。進一步來說,成功的基因治療或許僅僅需要一次治療,而不是終生的持續治療。
3.1基因治療在眼科領域的應用,代表公司Spark遺傳性視網膜病變(Inherited Retinal Diseases,IRDs)是一組罕見的眼睛疾病,由遺傳性基因突變造成,常會導致視力喪失或者失明。IRDs又可以細分為視網膜色素變性(Retinitis Pigmentosa, RP),雷伯氏先天性黑曚(Leber Congenital Amaurosis,LCA),先天性靜止性夜盲(Congenital Stationary Night Blindness,CSNB)等。由於IRDs大多由單個基因缺陷引起(由單個基因缺陷導致的IRDs的發病率大約是1/3000),同時因為眼睛是人體內相對獨立的,容易進行治療的器官,所以IRDs成為了基因治療的熱門研究領域。
以Spark公司為例,該公司成立於2013年,有超過20年的基因治療研究基礎,技術平台來源於費城兒童醫院,2015年初,登陸美國納斯達克。Spark公司2017年獲批上市的Luxturna是一款用於治療RPE65基因缺陷的遺傳性視網膜病變,只需要一次性治療。其中,RPE65基因編碼的RPE65蛋白是我們的視覺系統中一種非常重要的酶,可以催化11-順-視網膜(11-cis-retinal)異構化成為全反式視黃醛(All-trans-retinal),從而觸發光傳導通路(Phototransduction Pathway),最終讓大腦皮質的視覺中樞產生視覺。Spark預計在全美以及歐洲主要五國的患者人數達到3500人。
Spark的Luxturna是通過AAV病毒(腺病毒相關病毒)攜帶正常的RPE65基因,進入到視網膜內,正常的RPE65基因並不整合到人體細胞的DNA中,而是在細胞核中合成正常的RPE65蛋白,從而幫助觸發光傳導通路,恢復正常的視覺功能。當然,除了Spark,Editas等其他公司的產品管線內都有在研的針對IRDs的基因治療產品。
3.2基因治療在血友病領域的應用,代表公司:BioMarin基因治療另外一個潛在的重要領域就是血友病。血友病主要包括血友病A和血友病B,都屬於罕見的X染色體隱形遺傳病,分別由於缺乏足夠的凝血因子VIII和凝血因子IX兩種蛋白,從而導致凝血功能異常,發生持續性出血,嚴重時可以影響生命。全球血友病聯盟預測全球有超過15萬人患有血友病A,接近3萬人患有血友病B。BioMarin、Spark、Bioverative等公司都致力於研發血友病領域的基因治療產品,以下以BioMarin公司為例。
BioMarin是一家美國上市的生物科技公司,旗下的基因治療產品BMN270針對血友病A,和Spark一樣,也是採用AAV病毒,目前已經進入臨床三期。在17年美國ASH會議上,BioMarin公布了BMN270的最新數據,表明:對於注射劑量在6e13vg/kg的7名患者,在接受治療的78周後,凝血因子VIII水準的中位數和平均數分別達到90%和89%,根據全球血友病聯盟的定義,正常人的凝血VIII因子的水準在50%-150%之間。
同時,數據顯示,在接受治療的四周後,中位數的年化流血率(Annualized Bleeding Rate)以及凝血因子VIII的注射次數(Annualized FVIII Infusions)均為0,代表了沒有出現流血現象和接受傳統的替代療法。該數據非常正面,讓科研人員看到了基因治療在未來可以徹底治癒血友病的希望。
3.3基因治療在神經遺傳性疾病的應用,代表公司AveXis長久以來,基因治療在治療神經系統疾病挑戰非常大,困難包括病毒載體的安全性,運送病毒載體的方式等。而如今,以上兩個方面都取得了巨大的進步。尤其是科學家們發現AAV9病毒載體的相對安全性和有效性,以及可以穿過血腦屏障(Blood–Brain Barrier, BBB),成為了多個神經系統疾病基因治療項目的首選載體,其中為代表的包括AveXis公司(已被諾華收購)。
表4:部分使用AAV9基因療法治療神經系統疾病的臨床實驗:
| 1型脊髓性肌萎縮 | 血液 | 關鍵性臨床 | AveXis |
| 巴頓氏症(CLN6) | 脊髓液 | 臨床I/IIa期 | Nationwide Children"s Hospital |
| A型黏多糖症 | 血液 | 臨床I/II期 | Abeona Therapeutics |
| 巨軸索神經病 | 骨髓液 | 臨床I期 | National Institutes of Health |
資料來源:ClinicalTrial
AveXis是美國的一家生物科技公司,成立於2010年,致力於開發罕見和致命的神經遺傳疾病的基因治療產品,2016年登陸美國納斯達克。公司的主要產品AVXS-101是一款在研的用於治療脊髓型肌肉萎縮症(Spinal Muscular Atrophy,又簡稱SMA)的基因治療產品。
SMA是一種嚴重的神經肌肉疾病,由SMN1基因缺陷所致,發生率大約是每一萬個新生兒童中有一個例患有該疾病。在AVXS-101基因治療產品中,AAV9病毒載體被用於攜帶正常工作的人類SMN基因並通過靜脈給葯,被病毒攜帶進入細胞體內的SMN基因,並不整合到細胞原有的DNA分子內,而是通過轉錄和翻譯,製造出合適水準的SMN蛋白。
AVXS-101已經完成針對SMA一型患者的臨床一期試驗(公開標籤、劑量爬坡、用於衡量產品的安全性和耐受性),正在開展關鍵性臨床試驗(Pivotal Clinical Trial)。臨床I期試驗中,共入組了15名SMA一型嬰兒患者,分為兩組,一組是建議的劑量,入組了12名患者,一組是低劑量,入組了3名患者。在嬰兒患者年齡達到13.6個月的時候,無事件生存率(Event-free Survival)達到100%。而相對應的文獻數據顯示,患者在13.6個月的時候,無事件生存率僅為25%。截止臨床I期試驗結束,對於建議劑量的12名入組患者,中位年齡是20.2個月,有9名患者可以至少5秒鐘無需幫助的坐著。此外,該基因治療方案展示了良好的安全性和耐受性。
基因治療目前在研的罕見病還包括鐮刀型貧血症、Beta型地中海貧血症、脂蛋白酶缺乏症、黏多糖貯積症、腎上腺腦白質失養症等,除了我們上述提到的基因治療的公司,領先企業還包括Bluebird,uniQure、Sarepta、Tocagen等。
4.1 CAR-T:我國基因治療的熱門領域我國的基因治療目前主要是集中在CAR-T領域,從全世界的角度來看,全球CAR-T研究的公司主要集中在中國和美國,兩個國家從事CAR-T研究的公司佔比超過80%。
圖6:全球CAR-T公司地理分布

資料來源:Celltrials
2016年12月,原CFDA(現在改名為:國家藥品監督管理局,SDA)頒布《細胞製品研究與評價技術指導原則》,旨在規範和指導細胞治療產品,並在2017年底正式推出《細胞治療產品研究與評價技術指導原則(試行)》,按照藥品研發以及管理規範對CAR-T等細胞治療產品進行監管,明確CAR-T等細胞治療產品的申報原則。同時,南京傳奇生物的LCAR-B38M已經成功搶得國內首個CAR-T臨床批件。除了南京傳奇生物,我國從事CAR-T療法的公司還包括優卡迪生物、北京馬力喏、恆潤達生、博生吉等,不過大部分還是集中在血液瘤領域,多以CD19和BCMA為靶點,布局實力瘤的包括科濟生物等。與此同時,在監管層面,我國細胞治療產業也開始走向正規。早在2009年,免疫細胞療法作為第三類醫療技術進行管理,後在2015年7月衛計委決定取消第三類醫療技術臨床應用準入審批。2016年的「魏則西事件」震驚全國,反應了我國在該領域一直存在著監管不嚴,亂象叢生的現狀。
和全球趨勢一樣,我國從事TCR-T研發的公司較少,主要有香雪、因諾生物等公司致力於TCR-T技術的研發。另外,我國也已有公司開始把基因編輯技術應用到構建「通用型CAR-T」的研發過程中,例如上海邦耀生物, 但是還處在非常早期的階段。
| CAR-T | ||||
| 南京傳奇 | LCAR-B38M | BCMA | 多發性骨髓瘤 | 獲得臨床批件 |
| 葯明巨諾 | JWCAR028 | CD19 | 複發難治淋巴瘤和白血病 | 獲得臨床批件 |
| 北京馬力喏 | 抗CD19抗原受體修飾的自體T淋巴細胞注射液 | CD19 | B細胞淋巴瘤 | 臨床試驗申請獲得受理;優先審批 |
| 上海恆潤達生 | 抗人CD19 T細胞注射液 | CD19 | 急性B淋巴細胞白血病 | 臨床試驗申請獲得受理;優先審批 |
| 上海科濟生物 | 靶向磷脂醯肌醇蛋白多糖-3(GPC-3)嵌合抗原受體修飾的自體T細胞 | GPC-3 | 肝癌 | 臨床試驗申請獲得受理;優先審批 |
| 蘇州博生吉醫藥科技有限公司 | 靶向CD19自體嵌合抗原受體T細胞輸注劑 | CD19 | B細胞淋巴瘤 | 臨床試驗申請獲得受理 |
| TCR-T | ||||
| 香雪製藥 | 高親和性T細胞受體(TCR)細胞治療 | NY-ESO-1 | 實體瘤 | 正在進行研究者發起的臨床研究 |
| 深圳因諾免疫有限公司 | TCR-T細胞治療項目 | NY-ESO-1 | 實體瘤 | 正在進行研究者發起的臨床研究 |
| 通用型CAR-T | ||||
| 上海邦耀生物 | U-CART(基因編輯敲除MHC-1&TCR-α) | CD19 | B細胞惡性血液病 | 正在進行研究者發起的臨床研究 |
資料來源:公開資訊整理;註:葯明巨諾由葯明康德和Juno合資成立,資料截止日期20180628
和美國基因治療技術逐漸應用於罕見病不同,我國在罕見病領域的發展起步較晚,進展較慢,不利因素包括市場需求低、患者人數少、醫保難以支付等問題。
但值得欣慰的是,一方面,國家政策對於罕見病的重視程度逐漸加大,在今年五月份,國家衛生健康委員會等五部門聯合制定了《第一批罕見病目錄》,包含了121種罕見病。另一方面,也可以看到我國有機構開始涉足罕見病的基因治療領域,例如北京瑞希罕見病基因治療技術研究所,雖然還是屬於一個非盈利的科研部門,但致力於基因療法在罕見病領域的應用,目前旗下兩款在研藥物,分別是針對SMA和粘多糖貯積症III A型。
綜上所述,基因治療行業經過20多年的摸索,目前正處在高速發展期。在癌症領域,對於T細胞的體外基因改造,以CAR-T形式對血液瘤的治療取得的進展最快,2017年分別來自諾華和Kite的兩款CAR-T獲美國FDA批準,具有裡程碑的意義。TCR-T作為另外一種備受關注的癌症領域的基因療法,目前在實力瘤的應用被寄予厚望,代表公司包括英國的AdaptimmuneTherapeutics、德國的Medigene等,不過還有待臨床試驗的進一步驗證。
至於基因治療在罕見遺傳病領域的發展,欣喜地看到美國FDA已經批準了Spark公司針對眼部罕見病的Luxturna,同時基因治療在血友病、神經系統疾病、鐮刀型貧血症等多個罕見遺傳都呈現積極的進展,領先公司包括BioMarin、AveXis、Bluebird等等。以CRISPR/Cas9為核心的基因編輯技術的興起,美國三大基因編輯公司Editas Medicine、CRISPR Therapeutics和Intellia Therapeutics陸續登陸美股,更讓基因治療打開新的篇章。
我國基因治療領域,CAR-T是目前最受關注,也是資本、科研等集中力量投入的方向,尤其是我國細胞治療產業,經歷了之前不規範的不利影響,已逐漸走上正規,多家公司,包括南京傳奇、科濟生物、優卡迪、博生吉、恆潤達生等都已按照藥物批準流程,申報臨床試驗,且南京傳奇在多發性骨髓瘤領域的LCAR-B38M已獲得臨床批件。
面對國內競爭日益激烈的CAR-T領域,未來誰會勝出,需要關注的因素包括創始人背景、科研實力、技術路徑、靶點的選擇、CAR-T的品質控制、工藝的穩定性等等。另外,我國基因治療在TCR-T、罕見病等其他領域還處在比較早期的階段,還需要科研數據的進一步驗證,但也是目前值得關注的方向。總之,無論國外還是國內,基因治療作為一種新型的生物技術療法,給眾多患者帶來了前所未有的治療手段,帶來了新的希望。
來源:漢靚的醫藥科技前沿