本文內容來源於界面
8月20日,默沙東方面證實,第一批腫瘤免疫葯PD-1抑製劑Keytruda(即帕博利珠單抗注射液)已經於今日抵達中國,按照這個進度推斷,估計一個月左右患者便可以正式用到該新葯。
推薦閱讀:
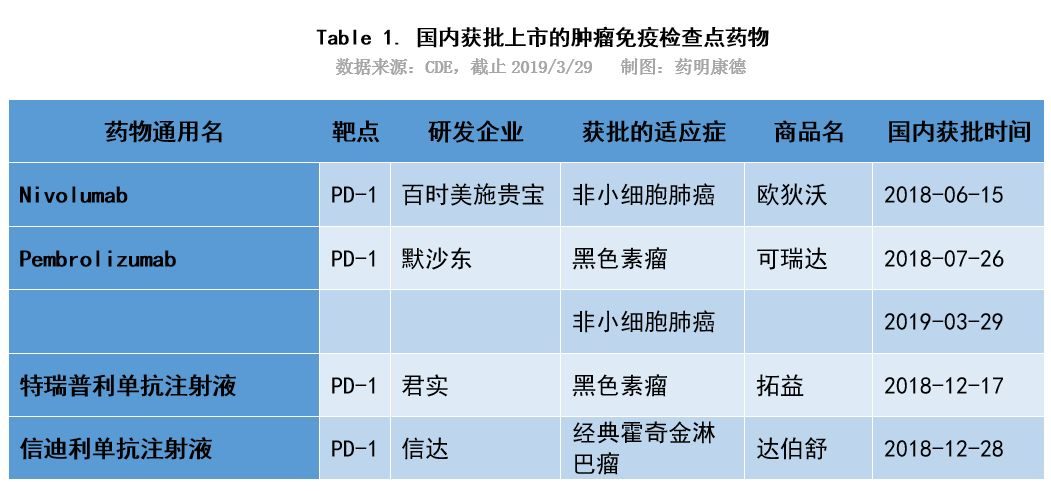
7月26日,默沙東公司宣布其PD-1單抗Keytruda的上市申請正式獲批。用於治療經一線治療失敗的不可切除或轉移性黑色素瘤的治療。Keytruda在民間又被稱為「k葯」,於2014年在美國上市。
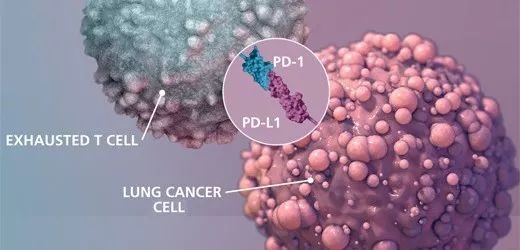
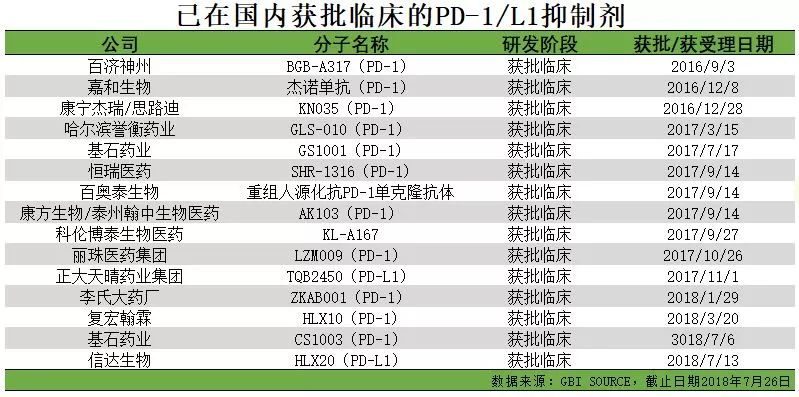
PD-1類藥物是一種免疫抑製劑,包括PD-1抗體和PD-L1抗體,被稱為廣譜抗癌靶向葯。如今,PD-1免疫療法是腫瘤免疫療法中極具代表性的一種療法。在全球範圍內,已經上市的PD-1/PD-L1抑製劑共有5種,分別為默沙東的Keytruda、百時美施貴寶的Opdivo、羅氏製藥的Tecentriq、輝瑞默克的Bavencio以及阿斯利康的Imfinzi。
黑色素瘤是一種惡性度較高的腫瘤,且容易轉移。在免疫治療出現之前,如果發生轉移,患者的整體5年生存率只有5%左右。Keytruda的出現則給黑色素瘤患者帶來了新的希望,2016年使用Keytruda 治療655位晚期黑色素瘤患者的研究顯示,患者整體中位生存為23個月,2年生存率達49%,有三分之一的人腫瘤實現縮小。
2018年2月11日,默沙東PD-1單抗Keytruda的上市申請獲得CDE承辦受理。從遞交上市到獲批僅用時163天,可以說是創下了中國進口抗腫瘤生物製劑最快審批記錄。
雖然在國內,帕博利珠單抗目前僅獲批用於治療黑色素瘤,不過,根據國家臨床試驗登記與資訊公示平台,默沙東目前在國內共登記開展了8項k葯相關的臨床試驗,涉及肺癌、黑色素瘤、胃癌、食管癌、肝細胞癌等5大腫瘤類型。
而從全球範圍獲批適應症數量來看,Keytruda在海外獲批的適應症覆蓋了非小細胞肺癌、MSI-H實體瘤、胃癌、頭頸癌、膀胱癌、子宮頸癌、霍奇金淋巴瘤、大B細胞淋巴瘤等多個瘤種。
國家葯監局藥品審評中心日前發布了《關於徵求境外已上市臨床急需新藥名單意見的通知》,為加快境外已上市臨床急需新葯進入我國,組織專家遴選了48種境外已上市臨床急需新藥名單,其中包括12款腫瘤葯,均為我國尚未上市,主要用於治療罕見病、防治嚴重危及生命或嚴重影響生活品質疾病且尚無有效治療手段或具有明顯臨床優勢的新葯。
納入名單的藥品,尚未進行申報或正在我國開展臨床試驗的,經申請人研究認為不存在人種差異的,均可提交或補交境外取得的全部研究資料和不存在人種差異的支持性材料,直接提出上市申請,加速審評審批速度。
Keytruda是此次入選這48個急需藥品清單的唯一一個腫瘤免疫治療PD-1藥物。這意味著Keytruda的新適應症或將加速獲批。
Keytruda剛進入中國,目前尚未進入醫保,考慮到腫瘤免疫療法在海外的價格,有消息稱默沙東也將聯合公益機構公布帕博利珠單抗患者援助項目,援助內容和細則將會在近期公布。
此外,默沙東透露,K葯加入了平安保險發布的中國首個商保腫瘤新葯目錄—《平安健康險腫瘤新葯目錄》,購買了此類商業保險的患者可以報銷這一藥物的費用。