「從遞交申請到獲得許可證,僅僅用了半年時間。創新葯審批提速不僅大大提升了企業的研發積極性,也讓患者得以更快用上新葯。」上海恆潤達生生物科技有限公司研髮帶頭人劉雅容博士說。
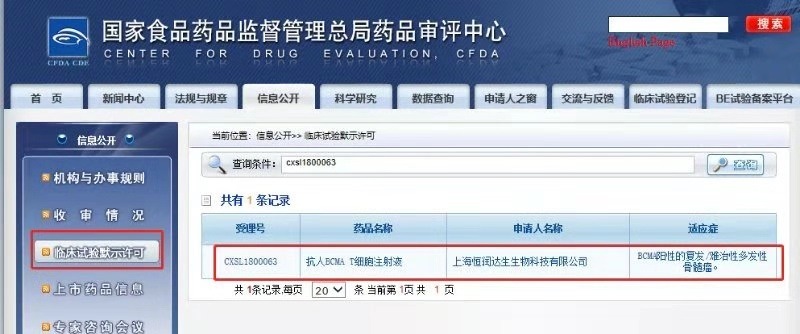
12月7日,用於治療B細胞成熟抗原陽性的複發/難治性多發性骨髓瘤的抗人BCMA T細胞注射液獲得國家藥品監督管理局臨床試驗默示許可。這也意味著,恆潤達生已獲得了國內7個CAR-T臨床批件中的3個,成為目前國內CAR-T項目進入藥物註冊臨床試驗最多的企業。
2017年頒布的《關於深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,標誌著葯審改革從局部向全面推進。今年11月初臨床試驗默示許可制度正式實施,令藥品審評改革再提速。
畢業於美國南加州大學的劉雅容博士多年來專註於CAR-T產品研發,回國工作的幾年中,國內營商環境的變化令她印象深刻。「伴隨新葯審批制度改革力度的加大,創新葯審批速度已經與國際一流對標。」劉雅容表示。
據國家藥品監督管理局官網披露的資訊顯示,截至10月,排隊等待審評的藥品註冊申請已由2015年高峰時的近2.2萬件降至3000件以下。
在華跨國製藥企業,正共享中國葯審改革提速帶來的「紅利」。母公司總部位於美國加州舊金山市的琺博進(中國)醫藥技術開發有限公司18日宣布,其創新研發的羅沙司他(愛瑞卓)正式獲得國家藥品監督管理局的上市批準,中國患者有望早於全球其他地區患者用上這一原研葯。羅沙司他計劃在2019年下半年向市場投放。
羅沙司他中國III期臨床試驗牽頭研究者、上海交通大學醫學院附屬瑞金醫院陳楠教授表示,作為全新作用機制的國際首創原研葯,羅沙司他在中國首先獲批上市,為中國慢性腎臟病(CKD)貧血患者帶來了有效且耐受良好的全新治療方案。(記者潘清、仇逸)