責編 | 酶美
NAD(P)H:醌氧化還原酶1(NQO1)是細胞質雙電子氧化還原酶,在大多數實體癌症中過表達,包括非小細胞肺癌、胰腺癌、乳腺癌、攝護腺癌、結腸癌和頭頸癌等,而在正常細胞/組織中表達非常低,因此是非常理想的癌症治療靶點。目前有很多抗腫瘤藥物的就以NQO1基因為靶點。β-Lapchone (臨床試驗形式ARQ761)是一種天然的萘醌類化合物,具有獨特的醌結構,可被NQO1催化產生活性氧(ROS)。通常情況下,1摩爾β-lap產生~120摩爾的超氧化物,在約2分鐘內消耗約60摩爾的NAD(P)H。NQO1在腫瘤細胞中過量表達,而過氧化氫酶在腫瘤組織中的表達與正常組織相比則大為降低。在人類癌症中高NQO1/過氧化氫酶比率可為使用NQO1「生物可活化」藥物提供最佳治療窗口,而低表達比率可保護正常組織[1]。腫瘤特異性的ROS大量產生可導致廣泛的氧化性DNA損傷和腫瘤選擇性細胞死亡。然而,在這一抗腫瘤過程中,免疫系統是否起到重要作用,目前尚未有明確報導。
7月19日,美國德州大學西南醫學中心傅陽心團隊與印第安納大學醫學院黃秀梅團隊合作在Nature Communications雜誌發表題為「NQO1 targeting prodrug triggers innate sensing toovercome checkpoint blockade resistance「的研究論文,首次證明靶向NQO1的抗癌藥β-lapchone引發先天性腫瘤免疫識別,導致T細胞介導的腫瘤抑製。

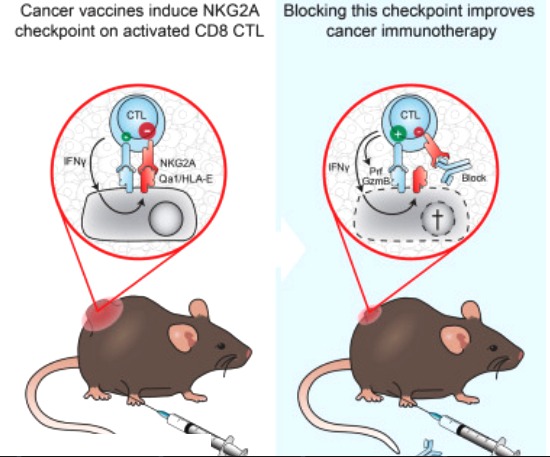
β-Lapachone被NQO1催化和生物活化,在高表達NQO1的腫瘤細胞中產生活性氧(ROS),引發氧化應激並釋放損傷信號以使機體產生先天性免疫識別。β-Lapachone誘導的HMGB1釋放激活了宿主TLR4 / MyD88/I型干擾素信號傳導通路和Batf3樹突細胞依賴性的交叉致敏,從而橋接針對腫瘤的先天性和適應性免疫應答。此外,靶向NQO1足以觸發腫瘤微環境內的先天性免疫識別,誘導T細胞再激活,以克服成熟腫瘤中免疫檢查點阻斷的抗性。此研究表明,靶向NQO1的抗腫瘤藥物可有效地觸發腫瘤微環境內的先天性免疫識別,並可與免疫療法協同作用以克服腫瘤的適應性耐葯。
製版人:小嫻子
參考文獻
1. Huang X, Motea EA, Moore ZR, YaoJ, , Dong Y, Chakrabarti G, Kilgore JA, Silvers MA, Patidar PL, Cholka A,Fattah F, Cha Y, Anderson GG, Kusko R, Peyton M, Yan J, Xie XJ, Sarode V,Williams NS, Minna JD, Beg M, Gerber DE, Bey EA, and Boothman DA. Leveraging anNQO1 bioactivatable drug for tumor-selective use of Poly(ADP-ribose) polymerase(PARP) inhibitors. Cancer Cell,2016, 30: 940-952.