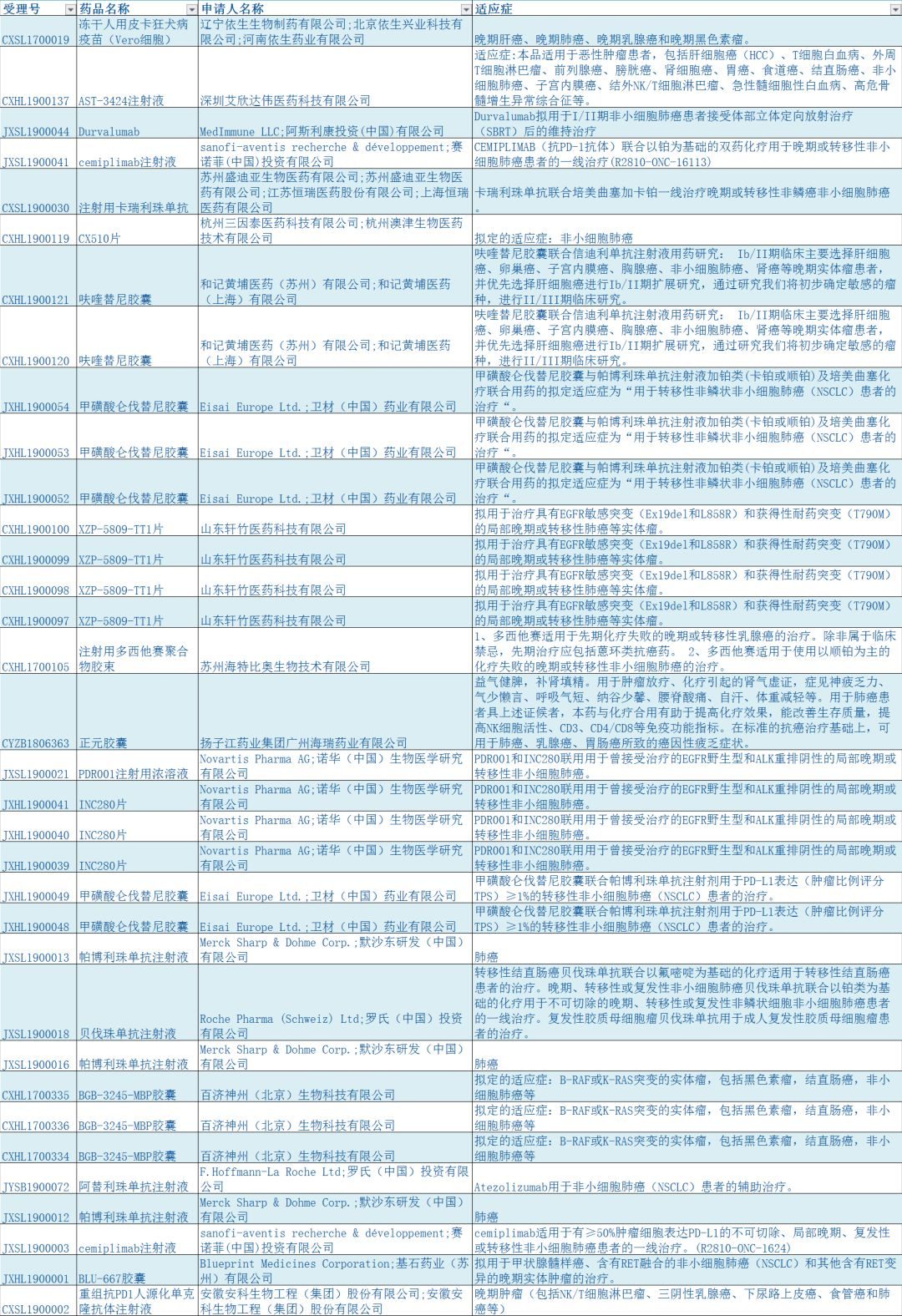
2019年3月29日/醫麥客 eMedClub/--今日,國家藥品監督管理局行政事項受理服務網站披露,默沙東旗下抗癌藥,PD-1抑製劑帕博利珠單抗注射液(英文商品名Keytruda,以下簡稱K葯),此前受理號為JXSS1800018的申請目前已審批完畢,狀態顯示為「審批完畢-待製證」。

據知情人士,此次國家葯監局審批完畢的是默沙東K葯在去年9月申請的聯合用藥療法,即該藥物聯合培美曲塞和鉑類化療藥物一線治療EGFR和ALK陰性的轉移性非鱗狀非小細胞肺癌(NSCLC)。
這也是默沙東K葯繼惡性黑色素瘤之後在內地獲批的第二個適應症。K葯此前在國內獲批適應症為黑色素瘤,但其在美國的六成以上銷售來源於肺癌。
作為全球癌症死亡的主要原因,全球每年有 159 萬人死於肺癌,平均每天 4350 例。且大約60%的肺癌患者在確診時,病情已經進入了晚期。肺癌主要分為兩大類型:非小細胞肺癌(NSCLC)和小細胞肺癌(SCLC),其中NSCLC約佔所有肺癌病例的85%,SCLC佔15%。
KEYNOTE-189研究是免疫檢查點抑製劑聯合化療用於NSCLC一線治療的第一個國際多中心雙盲、安慰劑對照III期臨床研究。
KEYNOTE-189研究的主要研究終點為無進展生存(PFS)和總生存時間(OS),ITT人群結果分析顯示帕博利珠單抗聯合化療組12個月預計OS率為69.2%,安慰劑聯合化療組為49.4%;HR=0.49。帕博利珠單抗組與安慰劑組患者中位PFS分別為8.8個月和4.9個月,HR=0.52。帕博利珠單抗組與安慰劑組患者預計12個月的PFS分別為34.1%和17.3%。總緩解率上帕博利珠單抗聯合化療組為48%,安慰劑聯合化療組為19%,整體數據上看K葯聯合化療優勢明顯。
2016年10月,K葯第一個一線治療晚期轉移性非小細胞肺癌的適應症在美國獲批(單葯一線治療無驅動基因突變的晚期非小細胞肺癌),隨後在歐美已相繼獲批聯合標準化療一線治療驅動基因陰性非鱗非小細胞肺癌和鱗狀非小細胞肺癌。
PD-1是目前癌症治療領域內的「新貴」,與傳統療法放化療不同,PD-1作用於人體的免疫系統,通過激活人體免疫力來對抗癌細胞,屬於免疫療法藥物。
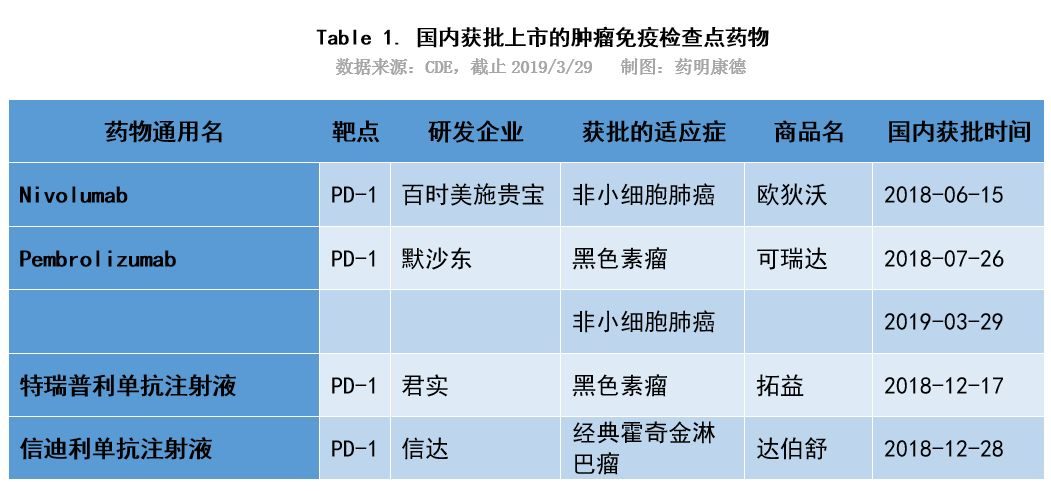
目前,國內市場已有百時美施貴寶、默沙東旗下兩款進口PD-1和君實生物、信達生物旗下兩款國產PD-1上市。恆瑞、百濟神州已提交BLA申請,預計將於年內上市。

值得注意的是,已經獲批的四款PD-1,除K葯外,各自獲批了一個適應症。默沙東PD-1獲批用於治療非鱗狀非小細胞肺癌一線治療(驅動基因突變陰性)和惡性黑色素瘤;君實生物PD-1獲批用於惡性黑色素瘤;百時美施貴寶PD-1獲批用於非小細胞肺癌二線治療(驅動基因突變陰性);信達生物PD-1獲批用於治療霍奇金淋巴瘤。
在價格方面,毫無疑問,國產PD-1相比進口產品更有優勢。

在PD-1藥物的競爭中,有價格因素,當然也有適應症、產能的問題。想要脫穎而出,勢必就要面臨轉型、另闢蹊徑,以求得差異化競爭,增強核心競爭力。或許,擴展適應證、探索聯合療法以及變革生產工藝,都將是未來的主要競爭方向。
參考出處:綜合整理自界面新聞、每日經濟新聞等
點擊圖片了解詳情

點擊下方,搶先報名參與大會!