作者:邵思源
編輯:王亞靜
乳腺癌是女性腫瘤中發病率最高的一類惡性腫瘤。根據中國抗癌協會公布的統計數字,我國主要城市近十年乳腺癌的發病率增長高達37%,是增長速度最快的癌症之一。《2017中國腫瘤登記年報》顯示,我國女性乳腺癌每年新增病例約21萬,是全球平均增速的兩倍。儘管早期乳腺癌患者會使用手術、化療、放療等治療手段,但仍然有30%-40%的乳腺癌患者會發生轉移,而不同乳腺癌病人發生轉移的時間差別巨大。


乳腺癌由幾種不同分子亞型構成,各種亞型之間在基因組變異方面有著明顯的差別,是一種高度異質性的疾病,表現為腫瘤內和腫瘤間的異質性。雖然乳腺腫瘤常被分為三種亞型,但根據雌激素受體(ER)、孕激素受體(PR)以及人表皮生長因子受體2(HER2)的表達情況,世界衛生組織根據遺傳學、病理學和臨床上的差異將乳腺腫瘤分為了20多種不同亞型[1]。癌症基因組圖譜(TCGA)的測序結果顯示,乳腺癌幾乎沒有一致突變的驅動基因,在93個乳腺癌基因中發現了1600多個可能的驅動突變[2],這些突變導致了我們所觀察到的臨床異質性。
乳腺癌異質性的特徵對新療法的設計至關重要,其面臨的挑戰主要表現在以下幾個方面:首先是腫瘤的時空異質性,這一特性導致同一患者的不同病灶區域具有不同的分子特徵,並在腫瘤進展過程中不斷變化。在腫瘤進展過程中,在原發或繼發部位可能發生克隆進化。其次,腫瘤微環境包括免疫浸潤會影響腫瘤細胞的行為和分子特徵,從而改變腫瘤的進展和轉移潛能。第三,腫瘤的分子特徵也可能在特定癌症治療的選擇壓力下發生變化[1]。例如對於診斷為ER陽性的乳腺癌患者,在經過內分泌治療後會出現ER陰性的腫瘤轉移情況[3]。


(圖片來源於網路)
儘管人們對乳腺癌複雜性的認識在不斷加深,但目前的治療方法主要是基於乳腺癌的臨床病理特徵,標準治療方法並不能適用於每個患者,因此從合理的靶向治療到實現個體化治療成為了科研人員的研究目標。然而,僅僅了解腫瘤的分子特徵只能指導治療,沒有功能驗證就不能預測臨床結果,因此需要一種乳腺癌模型能夠在功能上對乳腺癌的分子病理分析進行補充。
目前腫瘤新葯研究的主要工具是體外培養的腫瘤細胞系和在嚙齒類動物(主要是小鼠)上建立的人源腫瘤異體移植物模型(PDX)。細胞系是在次優環境下衍生的,由於二維培養的細胞系中腫瘤異質性和腫瘤微環境的缺失,因此其對藥物的反應與體記憶體在差異。最近的研究表明,乳腺癌細胞系的遺傳和轉錄進化可顯著改變藥物應答[4]。例如,在廣泛使用的MCF-7細胞系中,二維培養導致不同實驗室間的細胞系的生長速度、激素受體狀態、核型和克隆會存在差異。因此,與體內模型相比,使用細胞系來進行乳腺癌研究沒有明顯的優勢。同時越來越多的證據表明,小鼠與人在疾病過程中的變化及其對藥物的反應也存在一定的差異。小鼠模型通常只能模擬人類疾病的一個階段,不能完整地從病因、時間和進展速度等方面再現人腫瘤發生發展的全過程,因此以小鼠為模型的腫瘤治療研究並不能很好地預測其臨床應用的有效性。更重要的是,實驗小鼠基因背景、生長環境、致病因素和用藥處理均非常單一,自然無法完全模擬臨床上多種多樣腫瘤病人的複雜情況。

不同乳腺癌模型成功率比較
[5]:Fleur Weebe, et.al., Cell Chemical Biology, 2017)近年來類器官(Organoid)技術的發展為建立和分析病人樣本提供了新的機會。患者來源的類器官能複製原始腫瘤的重要特性,使惡性細胞在類似於乳腺腫瘤三維生長的條件下得以繁殖,並且能夠保持原始腫瘤的異質性。因此,類器官正在成為研究乳腺癌分子特徵的新模型,可以用於大規模藥物篩查,以發現與藥物敏感性有關的遺傳變化,在乳腺腫瘤精準醫學研究中具有重要意義。

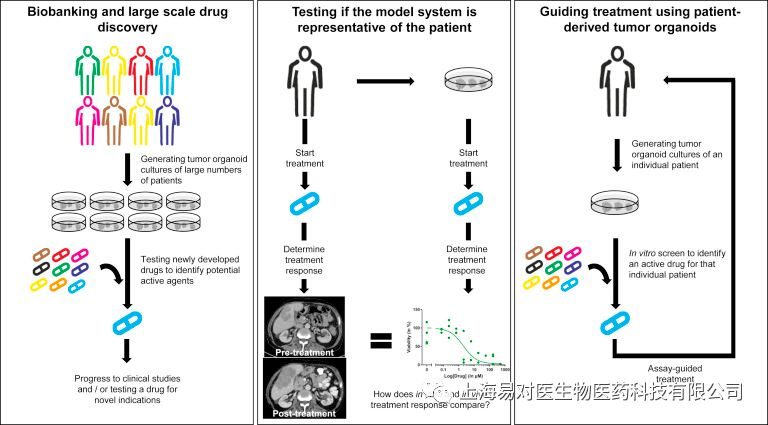
患者來源的腫瘤類器官及其應用
[5]:Fleur Weeber , et.al.,Cell Chemical Biology,2017)目前乳腺類器官技術經過不斷發展已逐步建立起來。20世紀80年代,Mina Bissell和她的團隊在研究乳腺癌的過程中率先建立了三維(3D)培養技術,並闡明了細胞外基質對基因表達的影響[6]。2007年,Bissell小組介紹了乳腺的正常細胞和腫瘤細胞三維培養的兩種方法[7]。2016年,中國首家專註於3D類器官培養技術的公司-上海易對醫生物醫藥科技有限公司成立,目前已與多家醫療機構合作成功建立了不同組織來源的腫瘤類器官,同時體液來源的腫瘤細胞的高效培養方法及循環腫瘤細胞的分離培養方法也已成功建立並分別提交了專利申請。目前乳腺癌類器官的生物樣本庫也正在建立中。2017年,Hans Clever團隊成功建立100多例乳腺癌原發瘤或者轉移瘤類器官,並且對模型進行了組織病理學、基因表達、基因測序等分析,同時還對乳腺癌類器官的葯敏活性進行深入研究。結果表明,乳腺癌類器官始終保持著原始組織的組織學、基因組和轉錄組特徵。而這些樣本中,75%ER/PR陽性的乳腺癌形成的類器官呈ER/PR陽性,90%ER/PR陰性的乳腺癌形成的類器官呈ER/PR陰性,80%HER2陽性的乳腺癌形成的類器官呈HER2陽性,90%HER2陰性的乳腺癌形成的類器官呈HER2陰性[8],說明在大多數樣本中,這些類器官都能與原始腫瘤組織狀態高度一致。
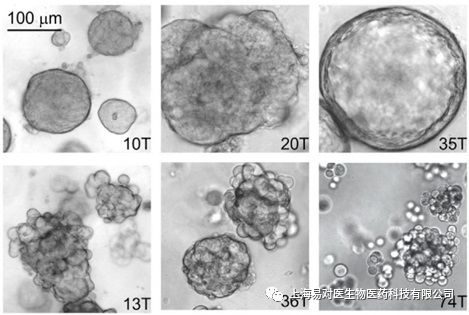
不同形態的乳腺癌類器官
[8]:Norman Sachs, et.al., Cell, 2017)


乳腺癌組織與類器官的組織學、免疫組化結果比較
[8]乳腺癌類器官的主要用途之一是藥物檢測。利用乳腺癌類器官進行體外葯敏實驗並用以指導臨床用藥,是類器官重要的臨床應用前景。Hans Clever團隊的研究發現,大部分高表達HER2的乳腺癌類器官對靶向HER2信號通路的治療敏感,而HER2陰性的類器官則不敏感;當乳腺癌類器官存在BRCA1/2通路突變時,類器官對PARP抑製劑敏感。把乳腺癌類器官移植到小鼠體內的結果表明,在小鼠體內試驗的葯敏結果與體外類器官結果一致。同時研究人員還發現臨床上患者對Tamoxifen的反應情況與體外類器官結果也是一致的。除了葯敏檢測以外,乳腺類器官也被用來進行與腫瘤發生和轉移相關的信號通路研究;同時,乳腺類器官還可以與CRISPR/Cas9系統結合,用於驗證或發現腫瘤發生過程中的重要基因。
乳腺癌類器官的成功建立為人們更好地探究乳腺癌發生發展的機制提供了一種非常有前景的新模型,希望未來通過結合基因組分析和藥物篩選的類器官研究能夠為乳腺癌患者帶來福音!
1. Roelofs C, et al. Breast tumour organoids: promising models for the genomic and functional characterisation of breast cancer. Biochem Soc Trans. 2019 Jan 9.
2. Nik-Zainal, S.,et al. Land scape of somatic mutations in 560 breast cancer whole-genome sequences. Nature. 2016 Jun 2;534(7605):47-54.
3. Dagogo-Jack, I. and Shaw, A.T. Tumour heterogeneity and resistance to cancer therapies.Nat Rev Clin Oncol. 2018 Feb;15(2):81-94.
4. Ben-David, et al. Genetic and transcriptional evolution alters cancer cell line drug response. Nature. 2018 Aug;560(7718):325-330.
5. Weeber F, et al. Tumor Organoids as a Pre-clinical Cancer Model for Drug Discovery. Cell Chem Biol. 2017 Sep 21;24(9):1092-1100.
6. Bissell, M.J.,et al. How does the extracellular matrix direct gene expression. J Theor Biol. 1982 Nov 7;99(1):31-68.
7. Lee, G.Y., et al. Three-dimensional culture models of normal and malignant breast epithelial cells. Nat Methods. 2007 Apr;4(4):359-65.
8. Sachs N, et al. A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell. 2018 Jan 11;172(1-2):373-386.