繼6月中旬首個PD-1抑製劑Opdivo在中國獲批上市後,默沙東旗下PD-1單抗產品Keytruda也接踵「閃電」獲批在中國上市。何時能用?效果如何?價格怎麼樣?無疑是Keytruda獲批後,患者當下最為關心的問題。可以預見2018年下半年還會有更多PD-1及PD-L1單抗產品在中國市場嶄露頭角。
7月26日清晨,國家藥品監督管理局更新消息,默沙東旗下PD-1單抗產品Keytruda(下稱:帕博利珠單抗)正式獲得批準在中國上市。自2月11日提交上市申請,到7月26日正式獲批上市,帕博利珠單抗注射液5個多月時間快速批準上市,創下了目前為止中國進口抗腫瘤生物製劑最快審批紀錄。
帕博利珠單抗注射液,英文商品名為Keytruda,中文商品名為齊內達(派姆單抗),學名為帕博利珠單抗(Pembrolizumab),是一種PD-1抑製劑藥物,PD-1是一種重要的免疫抑製分子,癌細胞經常利用它來逃脫免疫細胞對自己的殺傷。而帕博利珠單抗作用機制則是打破癌細胞對PD-1的利用,抑製PD-1,激活免疫細胞,從而達到控制癌細胞的效果。
帕博利珠單抗此前已經在國外獲批用於多種癌症治療,而此次在中國獲批的適應症則是獲批最早、最為成熟的晚期黑色素瘤治療,主要用於治療一線治療(患者初次化療或手術後的輔助化療)已經失敗,黑色素瘤不可切除或呈現轉移性的患者。
帕博利珠單抗此次能夠「閃電」上市,相當程度得益於進入到國家葯監局的優先審批通道。值得注意的是,不止是默沙東旗下的帕博利珠單抗及百時美施貴寶旗下的Opdivo(下稱:納武利尤單抗),君實生物、恆瑞醫藥及信達生物旗下三款PD-1單抗產品也進入到了優先審評通道,並且這三款產品在年初便已經獲得了CDE藥品審評中心受理上市申請,按照目前的審批進度,這三款產品也很有可能在2018年下半年有所突破。
◆ ◆ ◆
5個多月「閃電」獲批,PD-1、PD-L1蓄勢爆發
不止帕博利珠單抗,早在1個多月前另一款PD-1抑製劑納武利尤單抗也獲批在中國上市,納武利尤單抗獲得審評審批用了7個月時間。這兩款PD-1抑製劑快速獲批的關鍵在於葯監局加速審評審批政策。
默沙東中國在接受健康點記者採訪時表示,帕博利珠單抗注射液能在短短5個多月完成審評審批,中國葯監管理部門給予優先審批資格並首次通過同步臨床核查加速審批流程在其中「功不可沒」。而這些優先政策並非僅惠及帕博利珠單抗,而是在PD-1、PD-L1領域「雨露均沾」。
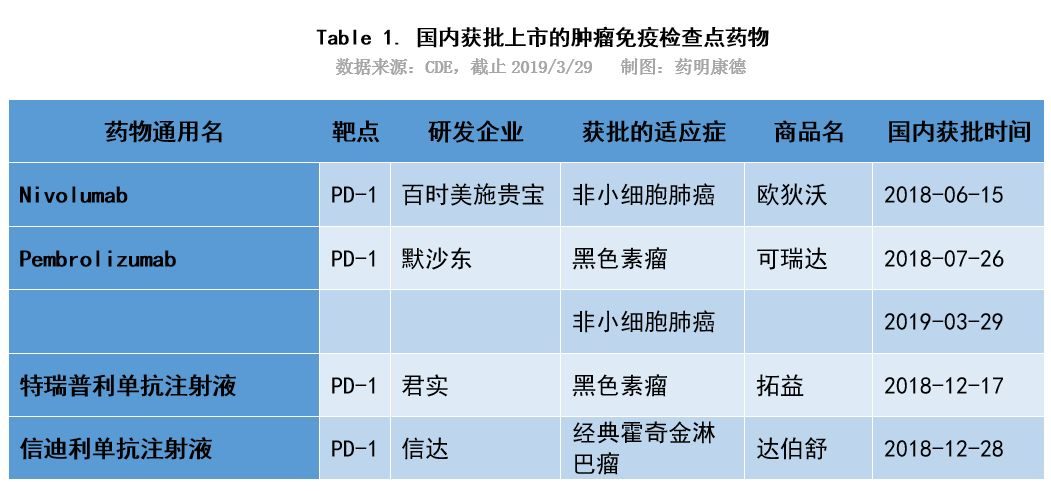
如上圖所示,除已經獲批上市的帕博利珠單抗及納武利尤單抗之外,君實生物、恆瑞醫藥以及信達生物的PD-1單抗產品上市申請都在優先審評行列中,這些產品快速落地到市場也有很大的可能性。
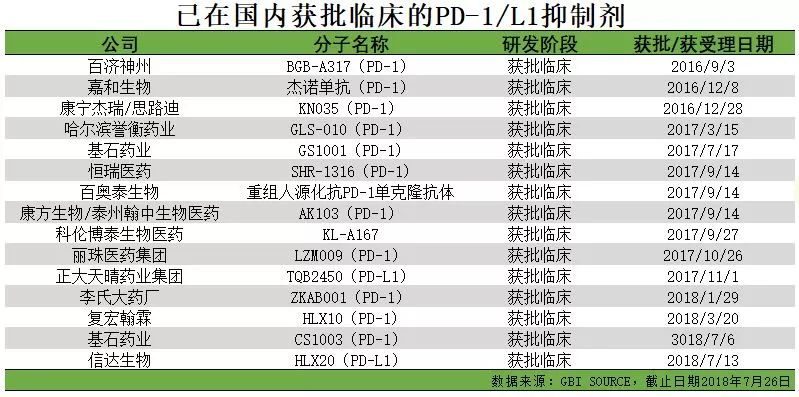
除接近上市階段的產品之外,還有相當數量的國內葯企的PD-1/PD-L1抑製劑產品處於臨床試驗階段。如上圖所示,已在國內相當數量的PD-1/PD-L1抑製劑在2017年、2018年集中獲批臨床,PD-1/PD-L1抑製劑未來將會成為非常熱門的領域。
◆ ◆ ◆
患者何時用得到Keytruda?
帕博利珠單抗此次獲批主要治療晚期黑色素瘤。黑色素瘤是一種來源於黑色素細胞的惡性腫瘤,是最致命的皮膚癌症之一,一旦發生轉移,患者的5年生存率不到5%。由於轉移率高、治療難度大、臨床預後差,黑色素瘤常常被稱為"癌中之王"。
在中國,2015年有大約8000例黑色素瘤新發病例和大約3200例黑色素瘤死亡病例。其中IV期(晚期)患者佔12.8%,3倍於美國(IV期僅佔4%)。在西方國家黑色素瘤多為皮膚型,而在中國,最常見的黑色素瘤亞型為肢端型(41.8%)和粘膜型(22.6%)黑色素瘤,由於其具有獨特的遺傳和臨床特徵,惡性程度較皮膚型黑色素瘤更高,臨床預後更差。由此可見,黑色素瘤在國內的治療形勢無疑十分嚴峻。
在中國,晚期黑色素瘤的治療仍以化療(達卡巴嗪/替莫唑胺)為主。然而化療方案在晚期黑色素瘤患者人群中的抗腫瘤活性非常有限。一項在中國受試者中開展的2期、隨機、雙盲、多中心研究顯示,達卡巴嗪作為一線治療,其客觀緩解率僅為3.7%,中位總生存期為8個月。根據北京腫瘤醫院的一項回顧性研究,局部晚期(不可切除的IIIB/C期)或轉移性(IV期)黑色素瘤患者在二線治療中,其客觀緩解率僅為3.5%,中位總生存時間為7.5個月。
去年在中國獲批的靶向藥物維莫非尼(BRAF抑製劑)儘管在BRAF突變型晚期黑色素瘤中具有較高的緩解率,但幾乎所有經治患者都會產生耐藥性,大約50%的患者在6個月內發生疾病進展。
而帕博利珠單抗注射液在晚期黑色素瘤領域的治療效果則十分突出。在一項包含173名病人的臨床研究中,接受其他治療後病情進展的晚期黑色素瘤患者使用帕博利珠單抗治療,劑量為每公斤體重2毫克或10毫克,24%的病人病灶顯著縮小,病情控制時間在1.4個月至8.5個月。
而2018 ASCO年會披露的KEYNOTE-001研究5年隨訪數據也表明,所有晚期黑色素瘤病人在使用帕博利珠單抗治療後,總生存時間超過5年的比例是34%。首次治療就使用帕博利珠單抗注射液治療的晚期黑色素瘤病人的總生存時間超過5年的比例是41%。
中國病人與外國病人之間或許存在一定差異,但帕博利珠單抗在中國的臨床效果保持了相當的穩定性。根據在中國進行的KEYNOTE151的中期研究結果,一線治療失敗的晚期黑色素瘤患者接受帕博利珠單抗作為二線治療的客觀緩解率達到16.7%,中位生存時間達到12.1個月。相當一部分患者療效持續,接受治療時間已接近兩年。
除去效果,價格是患者關心的另一個核心問題。目前,香港帕博利珠單抗注射液(100mg)價格為42000港幣/支,而默沙東中國在接受健康點採訪時表示,藥品定價與多種因素有關,包含大量研發、高品質生產和高標準管理的投入,未滿足醫療需求的程度、藥品給患者帶來的臨床獲益、商業和金融市場狀況等,帕博利珠單抗未來的定價將綜合多方考慮因素,積極探索多種模式,實現患者、藥物支付方及藥物研發方的共贏。
雖然帕博利珠單抗已經獲批在中國上市,但是患者真正能夠購買使用還需等待一段時間。默沙東中國在採訪中雖未預估患者最快多久能夠用上帕博利珠單抗進行治療。但對標先於帕博利珠單抗獲批上市的納武利尤單抗,其鋪貨速度應該不會太慢。
此前,健康點曾獨家報導,納武利尤單抗獲批上市後不到1個月,第一批納武利尤單抗注射液藥物便已運抵上海保稅區,在完成所有海關報關、檢驗等法定手續後的「一個月內」,全國患者就能用上納武利尤單抗。
◆ ◆ ◆
9個瘤種12個以上適應症
帕博利珠單抗注射液此次獲批的適應症雖然僅是晚期黑色素瘤的治療,但它在癌症治療領域的想像太空並不僅此。
從全球範圍獲批適應症數量而言,帕博利珠單抗注射液是目前用於治療晚期瘤種最廣泛的免疫藥物。它已在80多個國家獲批使用,覆蓋了9個瘤種的12個以上適應症,包括黑色素瘤,非小細胞肺癌,頭頸癌,霍奇金淋巴瘤,膀胱癌,宮頸癌,胃癌,B細胞淋巴瘤等。
而默沙東中國方面則表示,默沙東正繼續積極與政府、醫療機構、專家和相關醫學專業人士展開合作,繼續擴展帕博利珠單抗在中國的其他適應症,除黑色素瘤外,帕博利珠單抗已在中國啟動非小細胞肺癌,食管癌,肝癌等多個臨床註冊試驗。而目前,這些臨床試驗正在順利進展中。

如上圖所示,帕博利珠單抗注射液在不同癌種多個適應症的治療上展現出突出的適應能力。特別值得一提的是,帕博利珠單抗注射液在2017年革命性地被FDA批準上市用於所有存在DNA錯配修復缺陷的實體瘤的PD-1抑製劑,這意味著不管腫瘤的原發病灶是哪裡,只要是存在高微衛星不穩定性(MSI-H)或DNA錯配修復缺陷(dMMR),都可以使用帕博利珠單抗治療,帕博利珠單抗也因此成為了「廣譜抗癌藥」。
而近期,帕博利珠單抗在臨床上的表現也十分強勁。2018年4月公布的 Keynote-189數據顯示帕博利珠單抗聯合化療一線治療非鱗狀非小細胞肺癌(無論PD-L1表達情況如何)和標準化療相比減少超過50%死亡風險。2018年6月美國臨床腫瘤學年會公布的Keynote-407研究則顯示帕博利珠單抗聯合化療治療鱗狀非小細胞肺癌同樣和標準化療相比顯著減少死亡風險。
文|健康點healthpoint