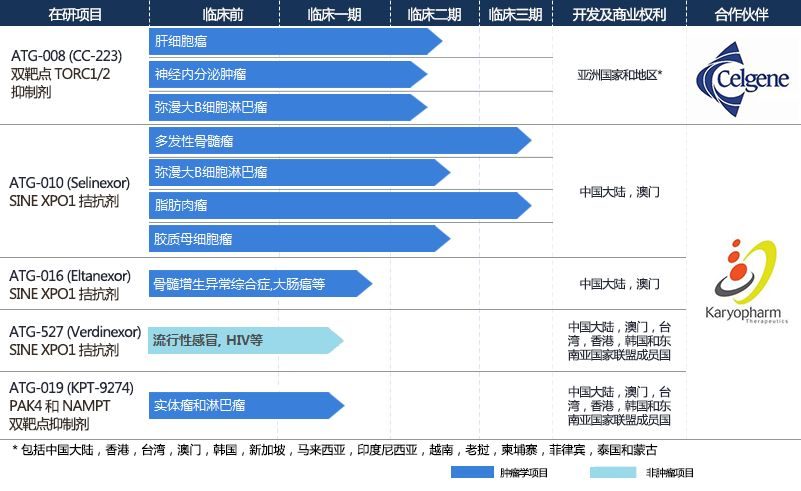
今日,FDA宣布,加速批準Karyopharm Therapeutics公司開發的Xpovio(selinexor)上市,與地塞米松(dexamethasone)聯用,治療複發/難治性多發性骨髓瘤患者。這些患者已經接受過至少4種前期療法,而且對多種療法產生抗性,包括至少兩種蛋白酶體抑製劑,至少兩種免疫調節劑和一種抗CD38單抗療法。他們代表著最為難治的多發性骨髓瘤患者群。這一批準也為Xpovio一波三折的審評歷程畫上了圓滿的句號。


多發性骨髓瘤是由於骨髓中的漿細胞癌變而導致的血液癌症。異常漿細胞在骨髓中聚集,在身體多處骨骼產生腫瘤。這些細胞不但不能行使正常功能,它們產生的抗體還會導致骨髓無法生成健康的血細胞。雖然目前對多發性骨髓瘤有多種療法,然而有很多患者仍然會對所有獲批療法都產生抗性,他們迫切需要使用創新機制來控制腫瘤的療法。
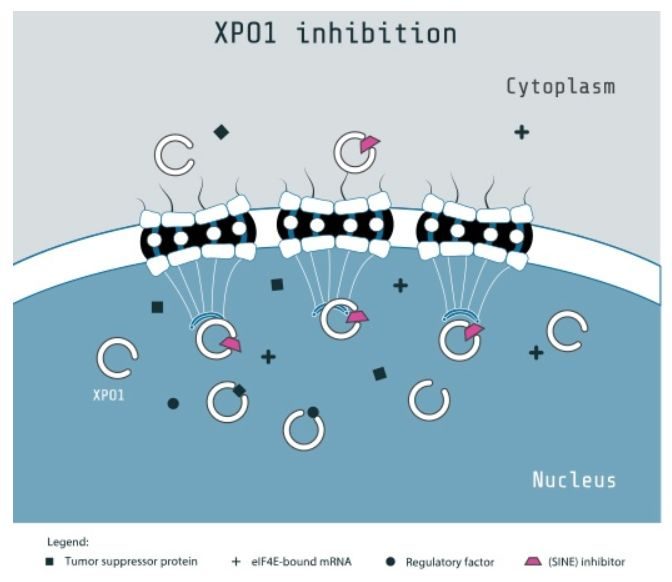
Karyopharm公司開發的Xpovio是一種口服的選擇性核輸出抑製劑,與核輸出蛋白(nuclear export protein)XPO1結合併且抑製它的功能,這會導致腫瘤抑製蛋白在細胞核中積累。腫瘤抑製蛋白的積累會重新啟動或增強它們的腫瘤抑製功能,在引發腫瘤細胞的特異性凋亡的同時,對正常細胞不會產生嚴重影響。

這一批準是基於Xpovio與地塞米松聯用,治療83名複發/難治性多發性骨髓瘤患者的療效結果。在這些高度難治的患者中,組合療法達到25.3%的總緩解率,緩解持續時間為3.8個月。
今年2月,FDA諮詢委員會投票表示,不支持Xpovio獲得加速批準,給這款新葯的獲批蒙上了一層陰影。隨後FDA宣布將審評過程延長3個月,Karyopharm公司也向FDA遞交了正在進行的3期臨床試驗中獲得的信息。FDA在批準的新聞稿中表示,對Xpovio的療效評估借鑒了最新遞交的臨床研究信息。
「雖然目前沒有治癒多發性骨髓瘤的方法,但是很多FDA批準的療法能夠延緩疾病的發展。不幸的是,很多時候,患者窮盡了所有治療選擇,疾病仍然繼續進展,」FDA腫瘤卓越中心主任Richard Pazdur博士說:「今天,我們使用加速批準途徑批準的這款療法,能夠為沒有治療選擇的多發性骨髓瘤患者提供新的治療選擇。」
參考資料:
[1] FDA approves new treatment for refractory multiple myeloma. Retrieved July 3, 2019, from https://www.prnewswire.com/news-releases/fda-approves-new-treatment-for-refractory-multiple-myeloma-300879990.html
本文來自葯明康德微信團隊,歡迎轉發到朋友圈,謝絕轉載到其他平台;如有開設白名單需求,請在文章底部留言;如有其他合作需求,請聯繫[email protected]