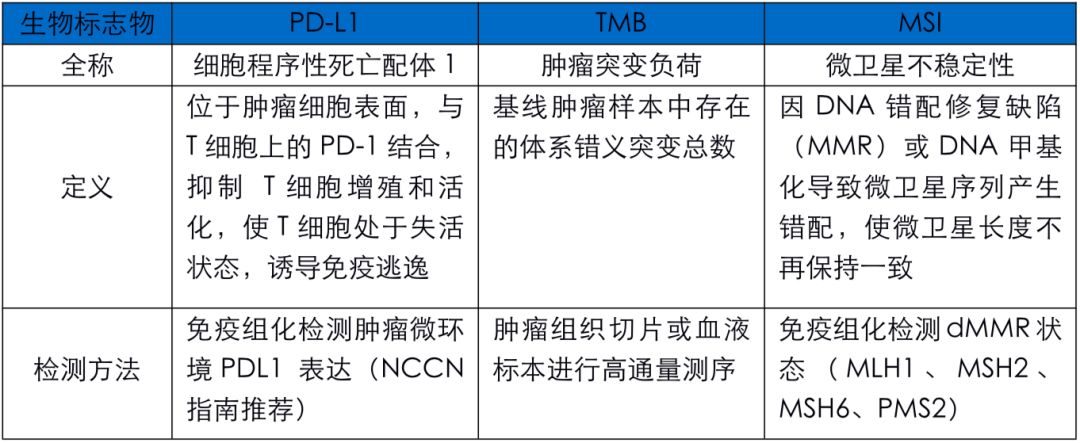
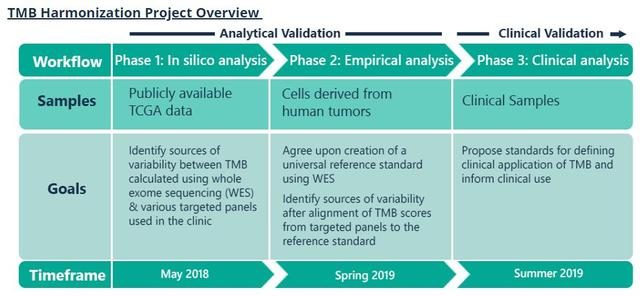
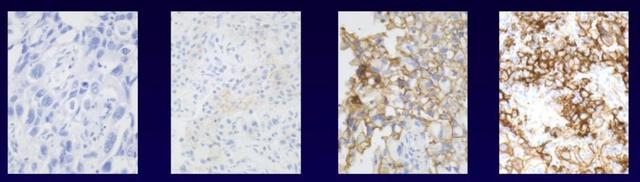
2018年頒發的諾貝爾生理學獎或醫學獎將「癌症免疫治療」推到了舉世矚目的位置,這種治療方法不直接損傷反而增強免疫系統,響應免疫療法的患者有很大機會高質量長期存活,目前免疫治療已在非小細胞肺癌的治療中展示出了強大的抗腫瘤活性。但在未經篩選的患者中,免疫治療的有效率只有10%~30%。作為中國腫瘤精準醫療領域先行者,泛生子致力更加精準地「引路」肺癌免疫治療。泛生子科學設計捕獲區域,採用國際主流演算法,聯合多檢測平台為臨床提供TMB、PD-L1、MSI、MMR等免疫治療相關生物標誌物的檢測(825基因檢測),可有效鎖定肺癌免疫治療獲益人群,評估肺癌免疫治療療效。
在肺癌精準診療領域,泛生子基因參與NCCN非小細胞肺癌指南中文版編譯工作的啟動標誌著中國腫瘤的診斷和治療同國際規範的接軌,也證明了中國基因檢測企業為肺癌精準醫療領域帶來了貢獻,亦獲得了國際認可。
到底哪些基因與肺癌治療相關,而臨床上較「火」的免疫治療又與哪些指標相關呢?
1. 與免疫治療療效負相關的基因
EGFR/ALK
Gainor等對免疫治療後的58位NSCLC患者進行了回顧性分析,結果見圖1,攜帶EGFR或ALK明確突變的患者免疫治療ORR(客觀緩解率)顯著較低(3.6% vs 23.3%, P = 0.053),通過對比這些患者PD-L1表達量及CD8+T細胞的結果,作者推測EGFR/ALK突變患者的免疫治療療效差的原因,可能是PD-L1表達量以及T細胞浸潤程度較低[1]。

EGFR-T790M
Haratani等選擇了25名EGFR陽性且EGFR-TKI治療後進展的NSCLC患者,分析了這些患者接受納武單抗治療後的療效與EGFR-T790M突變的關係,結果見圖2,EGFR-T790M突變陽性的患者免疫治療PFS顯著低於T790M陰性的患者(2.1m vs 1.3m,p=0.099),且EGFR-T790M突變陰性的患者腫瘤中PD-L1的表達量更高[2]。

STK11
2017ESMO大會上,Philip J. Stephens團隊公布了他們通過全基因組測序的方法研究基因突變與免疫治療療效之間關係的研究結果。他們對1619名NSCLC患者的組織樣本進行了全基因組測序及PD-L1的檢測,並計算了這些樣本的TMB,結果表明,PD-L1表達與TMB並無顯著相關性。此外,200多名患者被發現存在STK11失活突變,且多為肺腺癌患者,這些患者的腫瘤組織中免疫細胞浸潤較少(圖1A, 彩色直線代表多種免疫細胞相關基因的表達),免疫治療療效也較差(圖1B,P=0.0314),這些結果表明,STK11的失活突變可能與免疫治療療效負相關[3]。

2. 與免疫治療療效正相關的基因
POLE
POLE基因參與DNA的複製過程,在修復DNA複製錯誤的過程中起著重要作用,因此,POLE基因的突變會導致細胞中突變增多,但是從治療的角度看,POLE突變也正是腫瘤抗原增加的一個重要標誌。在非小細胞肺癌、子宮內膜癌以及腸癌中已經有了POLE基因突變影響免疫治療療效的報導,這些報導表明,POLE基因突變的癌症患者腫瘤突變負荷較高,也更容易從PD-1/PD-L1免疫治療中獲益。
KRAS激活突變
Lecuona等對129名既往接受免疫治療的晚期NSCLC患者進行了回顧性分析,發現14名患者攜帶KRAS激活突變,作者對這14名KRAS突變的患者免疫治療後的療效進行了分析,具體信息及分析結果見表1,KRAS突變的患者均為肺腺癌,且90%以上是吸煙患者,主要發生的是KRAS第12號外顯子和13號外顯子的激活突變,對免疫治療的響應率高達71.4%,且其中42.8%的患者響應持續長於12個月,根據目前的隨訪時間,KRAS突變患者的免疫治療中位PFS為7.65個月,中位OS為58個月,57%的患者仍然在繼續治療,這表明,KRAS突變與免疫治療療效可能是正相關的。

今年9月的ESMO剛剛報導完KRAS激活突變與免疫治療療效正相關的結果,今年12月Julian Downward團隊就在頂級期刊Immunity上發表了有關RAS突變影響免疫治療機制的文章,他們發現RAS基因突變可以通過促進PD-L1蛋白的積累來阻礙免疫細胞對腫瘤細胞的識別(圖4),這表明,RAS基因未來可能作為判斷免疫治療療效的潛在標誌物[5]。

TP53
Scheel等對436名NSCLC患者腫瘤組織中基因的突變狀態和PD-L1的mRNA表達量進行了分析,分析結果如圖5,結果表明,KARS/TP53突變與PD-L1的表達呈正向關係,而STK11基因的突變與PD-L1的表達呈負向關係[6]。

吳一龍教授團隊2016年發表在CCR上的一篇文章表明,TP53基因突變與PD-L1的表達呈正向關係,與之前的研究結果一致,且TP53基因突變的NSCLC患者中位PFS顯著長於TP53野生型患者(圖6, 14.5m vs 3.5m, P=0.042)[7]

MET
同樣是2017年ESMO大會的報導,MET突變的患者腫瘤組織中免疫細胞相關基因的表達顯著高於MET野生型患者,因此,MET基因的突變與免疫治療的療效也存在潛在的正向關係,但仍需要較多的臨床證據支持[8]。

3與免疫治療抗性相關的基因
免疫治療雖然是一種長效的藥物,但是也會產生抗性。2017年年初George等發表在Immunity上的一篇文章報導了轉移性子宮內膜瘤對免疫治療產生抗性的可能機制,分析對象為一名經過兩年帕姆單抗一線治療後進展的晚期子宮內膜瘤患者,通過對其免疫治療前後腫瘤組織的全基因組測序以及轉錄組測序,尋找到差異基因PTEN,並通過進一步的體外實驗,表明PTEN缺失可能導致腫瘤細胞無法被T細胞識別,從而對免疫檢查點抑製劑產生抗性[9]。
黑色素瘤中也有一些有關免疫治療抗性的研究,主要機制是腫瘤細胞中JAK1/2基因以及B2M(Beta-2 microglobulin)基因的失活突變[10]。
4 與免疫治療後腫瘤爆髮式進展可能相關的基因
Kato等研究了155名腫瘤患者(主要為NSCLC患者和黑色素瘤患者)基因突變與免疫治療爆髮式進展之間的關係,他們將爆髮式進展的判斷標準設定為治療失敗時間(TTF)<2個月,且與之前相比,腫瘤負荷增加50%以上,進展速度(與治療前相比)>2倍。
結果發現,攜帶MDM2/4擴增的6名患者,TTF均<2個月,其中4名患者在使用免疫檢查點抑製劑治療後,發生了爆髮式進展(圖8為一名MDM2擴增的肺腺癌患者免疫治療後爆髮式進展的影像學結果);攜帶EGFR突變(激活突變、擴增)的10名患者中,8名患者TTF<2個月,其中兩名患者使用免疫檢查點抑製劑治療後發生了爆髮式進展。
雖然研究的患者數量仍然較少,但以上結果初步可以表明,MDM2/4的擴增可能是腫瘤爆髮式進展的機制之一,EGFR突變的患者更大的可能是對免疫治療不敏感[11]。

小結
通過對免疫治療患者基因突變情況的回顧性分析可知:不同基因的突變可能導致免疫治療效果的諸多差異。基因檢測在腫瘤治療過程中的作用已經不止於指導靶向治療,它還有更大的應用範圍,比如輔助判斷免疫治療的療效,並且,顯而易見的是,更多更全面的基因檢測會給治療帶來更全面的指導。
泛生子提供的825基因檢測,不僅包含以上所有基因,還包含多維度的免疫治療相關生物標誌物檢測(TMB、MSI、PD-L1、免疫療效相關基因變異),通過獲取較全面的腫瘤分子信息,從而更精準地篩選免疫治療、靶向治療乃至聯合治療獲益人群,綜合評估各項治療效果,指導個體化診斷和治療,為實體瘤患者提供更多生存獲益的可能。基於高通量、高靈敏度的NGS平台和「雜交捕獲」技術,一次性檢測825個癌症相關基因,涵蓋了更新版本的WHO、NCCN、ESMO等權威指南及專家共識推薦檢測基因,並結合泛生子基因上萬例中國腫瘤患者的基因突變區域和遺傳突變位點信息開發設計,多平台的聯合應用可提供多維度的免疫治療相關生物標誌物檢測(TMB、MSI、PD-L1、免疫療效相關基因變異),從而更精準的指導腫瘤患者的個體化診療,亦為科研人員提供更加全面的參考信息。
參考文獻
[1] Gainor J F, Shaw A T, Sequist L V, et al. EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non-Small Cell Lung Cancer (NSCLC): A Retrospective Analysis[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2016, 22(18):4585.
[2] Haratani K, Hayashi H, Tanaka T, et al. Tumor Immune Microenvironment and Nivolumab Efficacy in EGFR Mutation-Positive Non-Small Cell Lung Cancer Based on T790M Status after Disease Progression During EGFR-TKI Treatment.[J]. Annals of Oncology, 2017.
[3] ESMO 2017 Abstract #1138
[4] ESMO 2017 Abstract #1174
[5] Matthew A. Coelho, Sophie de Carné Trécesson, Sareena Rana, et al. Oncogenic RAS Signaling Promotes Tumor Immunoresistance by Stabilizing PD-L1 mRNA. Immunity (2017). DOI: 10.1016/j.immuni.2017.11.016
[6] Scheel A H, Ansén S, Schultheis A M, et al. PD-L1 expression in non-small cell lung cancer: Correlations with genetic alterations.[J]. Oncoimmunology, 2016, 5(5):-.
[7] Dong Z Y, Zhong W Z, Zhang X C, et al. Potential Predictive Value of TP53 and KRAS Mutation Status for Response to PD-1 Blockade Immunotherapy in Lung Adenocarcinoma[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2017, 23(12):3012.
[8] ESMO 2017 Abstract #1138
[9] George S, Miao D, Demetri G D, et al. Loss of PTEN Is Associated with Resistance to Anti-PD-1 Checkpoint Blockade Therapy in Metastatic Uterine Leiomyosarcoma.[J]. Immunity, 2017, 46(2):197-204.
[10] Zaretsky J M, Garcia-Diaz A, Shin D S, et al. Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma[J]. New England Journal of Medicine, 2016, 375(9):819.
[11] Kato S, Goodman A M, Walavalkar V, et al. Hyper-progressors after Immunotherapy: Analysis of Genomic Alterations Associated with Accelerated Growth Rate.[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2017, 23(15):4242.