本文經公眾授權轉載


癌症免疫療法的起源可以追溯到19世紀80年代美國醫師威廉·科利(William Coley)的開創性工作,William Coley發現肉瘤患者在患丹毒後腫瘤消退,推測存在某些病原微生物激發了機體的抗腫瘤活性,隨後應用化膿性鏈球菌以及黏質沙雷菌濾液治療一些腫瘤患者並取得一定療效,該臨床應用標誌著腫瘤免疫治療的開端。
雖然該方法由於患者響應不一致而備受爭議,但是將細菌引入腫瘤產生免疫反應仍然是一個強有力的想法。細菌提供佐劑(如細胞壁成分脂多糖和肽聚糖等物質)激活固有免疫受體,識別微生物中常見的分子模式。死亡的腫瘤細胞釋放的抗原被活化的樹突狀細胞吸收,然後遷移到引流淋巴結,使細胞毒性T細胞活化,尋找並摧毀腫瘤細胞,激活適應性免疫。
合成生物學通過對活細胞的基因改造,正在推動醫學的一個新時代的發展。一個特別值得關注的領域是將細菌作為治療遞送系統,在體內選擇性釋放治療藥物。
2019年7月3日,哥倫比亞大學的Nicholas Arpaia教授和Tal Danino教授團隊在頂級醫學期刊 Nature Medicine 雜誌上發表了題為:Programmable bacteria induce durable tumor regression and systemic antitumor immunity 的研究論文。
該研究報導了一種使用群體感應細菌治療癌症的策略,這種策略利用細菌傳遞納米體的單鏈抗體片段,該單鏈抗體可以靶向吞噬細胞的抑製配體CD47,從而導致小鼠全身抗腫瘤免疫誘導的腫瘤快速消退。


CD47是癌細胞表面的一類「別吃我」信號,它通過與巨噬細胞表面的SIRP-α相互結合抑製巨噬細胞的吞噬作用。CD47廣泛地表達於各類癌細胞表面,因此以CD47為靶點,可以用於治療各種類型的癌症。近年來的研究表明,阻斷CD47不僅能增加對腫瘤細胞的吞噬作用,而且能促進腫瘤抗原的交叉表達,增強小鼠腫瘤模型中抗腫瘤效應T細胞的啟動。


然而,在臨床前模型和人體試驗中均顯示,系統性CD47阻斷可導致貧血和血小板減少,因為CD47分別在紅細胞和血小板上表達較高。為了提高其治療效果,最近開發了一種針對CD47的納米體,其結合親和力比市場上可用的抗小鼠CD47單克隆抗體高約200倍。由於缺乏Fc介導的效應功能,該納米體作為單一療法效果並不明顯; 然而,當聯合使用腫瘤特異性抗體和全身免疫檢查點阻斷劑時,效果便很顯著。
該研究團隊使用合成生物學來構建大腸桿菌中的「群體感應」基因電路,它包含一個同步裂解迴路(eSLC),可以在腫瘤上定植並在腫瘤內群體裂解,從而在局部釋放編碼的CD47納米體拮抗劑(eSLC-CD47nb)。研究發現,腫瘤定植細菌傳遞CD47nb可增加腫瘤浸潤性T細胞的活化,刺激腫瘤快速消退,防止轉移。
此外,研究人員評估了eSLC-CD47nb誘導骨髓衍生的巨噬細胞(BMDM)對A20腫瘤細胞的吞噬作用的能力。與預期一致,用抗CD47單克隆抗體處理導致吞噬作用增加60%,僅用eSLC裂解物處理導致腫瘤細胞的吞噬作用增加50%。值得注意的是,與基線相比,eSLC-CD47nb裂解液處理導致吞噬率增加90%,表明eSLC-CD47nb通過CD47阻斷和TLR激動作用(由於細菌裂解佐劑)以一種組合的、劑量依賴的方式增強巨噬細胞對腫瘤細胞的吞噬作用。總之,這些結果表明eSLC-CD47nb以裂解依賴性方式釋放CD47nb,並且CD47nb可在體外通過BMDM誘導腫瘤細胞的吞噬作用。
接下來,研究人員評估了eSLC-CD47nb細菌在同系小鼠模型中的臨床功效。雙側均有A20腫瘤的BALB/c小鼠,分別接受腫瘤內注射PBS、eSLC菌或eSLC-CD47nb菌。雖然僅給予eSLC的對照組最初減緩了腫瘤的生長,這可能是由於細胞群溶解後釋放的細菌產物激活了固有免疫細胞,但最終的腫瘤體積與PBS處理的小鼠並無統計學差異。相反,使用eSLC-CD47nb可在治療開始後約10天內快速、持久地清除A20腫瘤。並且,在治療後30天用eSLC-CD47nb治療的小鼠中很少觀察到肝轉移。值得注意的是,用eSLC-CD47nb治療的大約80%的小鼠存活超過90天,並且存活的小鼠對再注射A20腫瘤細胞具有抗性。


隨後,研究人員探討了群體溶解系統的各個組分的治療性遞送的重要性。首先,他們評估了單獨腹腔注射miap301和腹腔注射miap301的同時也瘤內注射eSLC對CD47的阻斷效果。與小鼠A20腫瘤模型中單獨的eSLC治療相比,兩組均未顯示出明顯的功效。雖然用重組CD47nb或超聲處理的eSLC-CD47nb細菌裂解物進行瘤內處理的小鼠與用eSLC處理的小鼠相比表現出較慢的腫瘤生長,但是只有在用表達eSLC-CD47nb的活細菌處理後才能觀察到完全腫瘤消退。因此這些數據表明, SLC介導的CD47nb在腫瘤內持續釋放對治療功效至關重要。


為了評估該方法的更廣泛的適用性,研究人員還在其他同系小鼠模型中,通過靜脈注射eSLC-CD47nb檢測了其治療功效。研究人員在攜帶三陰性乳腺癌細胞(4T1)和黑素瘤細胞(B16-F10)的小鼠腫瘤模型中觀察到了顯著的治療效果。
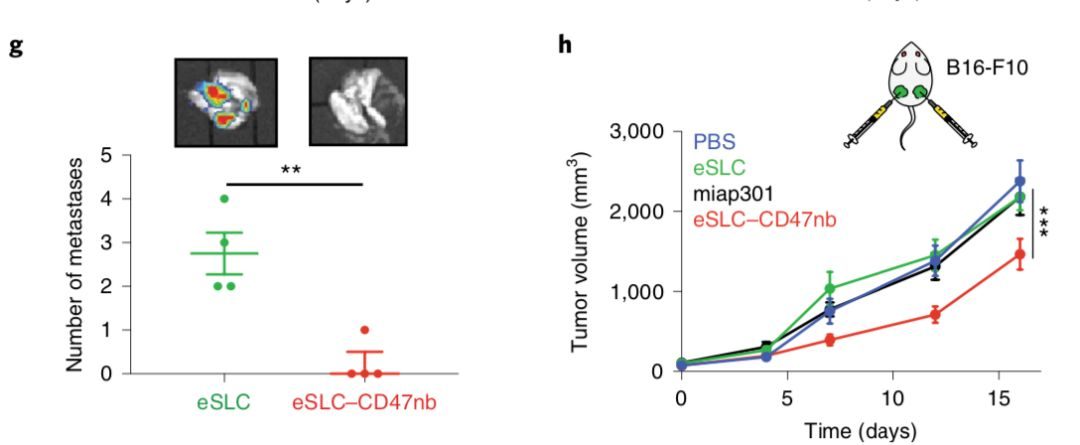

研究人員還探索了eSLC-CD47nb通過全身靜脈輸送安全靶向和治療腫瘤的能力。與接受全身遞送的抗CD47抗體(miap301)的小鼠相比,靜脈內注射eSLC-CD47nb的小鼠顯示出顯著更慢的腫瘤生長。在治療之後,與肝,脾和腎相比,細菌專門定位於腫瘤。動物對細菌療法具有良好的耐受性,在腫瘤內和靜脈內遞送後的整個觀察期間觀察到的治療組之間體重沒有顯著差異。
總體而言,這些結果表明,eSLC-CD47nb可以安全地促進局部腫瘤消退,同時還可以預防轉移,這表明全身性抗腫瘤免疫的誘導可能是由腫瘤特異性T細胞介導的。
對於這一重要研究,Nature Medicine 給予了高度評價:Programmable bacteria as cancer therapy(工程細菌用於癌症治療)


成功誘導T細胞反應需要同時存在抗原和佐劑。微生物為誘導抗腫瘤免疫提供了一種方便的方法。溶瘤病毒是利用微生物作為癌症治療的首批成功嘗試之一,2015年,在轉移性黑色素瘤內注射以皰疹病毒為基礎的T-VEC (talimogene laherparepvec)療法獲得了美國食品藥物監督管理局(FDA)的批準。
細菌提供了一種正交的方法,這裡描述的群體感應細菌實現了三個主要的工程成就。
首先,這些細菌提供了豐富的佐劑,並能在腫瘤中持續高水準存在長達一周。
其次,局部給葯和群體溶解可防止敗血症和治療藥物泄漏進入血液循環,從而減少藥物的全身暴露,從而避免導致限制治療毒性和產生抗藥物抗體。
最後,細菌具有巨大的基因載體能力並且可以被隨意修改。
總而言之,從局部產生中獲益的其他基於蛋白質的療法包括細胞因子和趨化因子,它們在局部發揮作用,每個分子的效力比阻斷抗體更高。21世紀的分子生物學工具已經將科利毒素(Coley』s Toxins)轉化為可編程的藥物遞送平台。