近一個月來,國家藥品監督管理局動作不斷,對多款注射劑說明書中的「不良反應」「禁忌」等項進行了修訂。
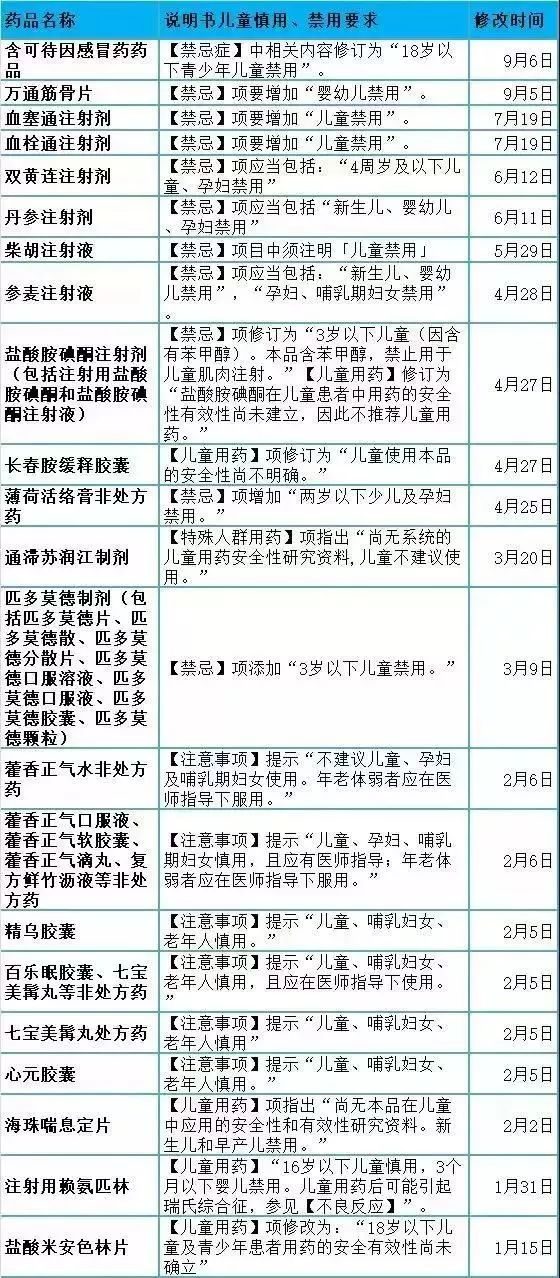
21世紀經濟報導記者梳理髮現,5月底至今,共有6款注射劑被國家葯監局點名,要求有關生產企業按照說明書修訂要求提出修訂說明書的補充申請,並在一定時限內報省級食品藥品監管部門備案,同時在補充申請備案後6個月內對已出廠的藥品說明書及標籤予以更換。
這6款注射劑分別為清開靈注射劑、注射用益氣復脈(凍乾)、天麻素注射劑、丹參注射劑、雙黃連注射劑和柴胡注射液。值得一提的是,除了被從中成藥目錄調至西藥目錄的天麻素注射劑外,其他五款全部為中藥注射劑。
其中,說明書中「禁忌」項的變化最值得關注。清開靈注射劑、丹參注射劑被要求增加「新生兒、嬰幼兒、孕婦禁用」,雙黃連注射劑被要求增加「4周歲及以下兒童、孕婦禁用」,而柴胡注射液則要求「兒童禁用」。
上海中醫藥大學附屬曙光醫院主任醫師蔣健告訴21世紀經濟報導記者,修訂說明書主要是出於安全的考慮,尤其是針對兒童這一特殊人群。而目前啟動的藥品注射劑再評價工作,企業是主體,應調動企業積極性進行再評價工作,保證注射劑的安全性和有效性。
保障公眾用藥安全
三個月前,國家藥品監督管理局正式揭牌。考慮到藥品監管的特殊性,國家葯監局得以單獨組建。近期監管部門對注射劑的一系列行動,正是根據藥品不良反應評估結果,進一步保障公眾用藥安全的體現。
7月6日,在於北京召開的全國藥品監管工作座談會上,國家葯監局局長焦紅在部署2018年下半年工作時提到要強化事中事後監管,聚焦幾類高風險產品,注射劑為其中之一,與疫苗、血液製品、植入類醫療器械等被一同提及。
注射劑有何特殊之處?北京大學醫學部藥學院系主任、教授史錄文告訴記者,從用藥角度來講,能口服就不要注射,能注射就不要靜脈滴注。口服藥物經過胃腸道系統的消化吸收後,方可進入人體內部流通;而注射劑經注射後直接進入血液循環,對其安全性要求應更高。
記者了解到,注射劑在臨床使用中存在一些不合理現象,主要表現為超劑量、超適應症、超適用人群用藥,不合理長期用藥,用藥方法不當,如靜脈給葯濃度過高、滴速過快,未注意配伍禁忌,將存在配伍禁忌的藥物混合配伍或使用同一點滴器連續滴注,聯合用藥不當等。
國家葯監局近日公布的《2017年國家藥品不良反應監測年度報告》(以下簡稱《報告》)顯示,2017年藥品不良反應/事件報告涉及的藥品給葯途徑分布中,注射給葯佔整體報告的64.7%,嚴重報告中涉及注射給葯途徑的佔77.6%。而不管是化學藥品、生物製品還是中藥,2017年不良反應/事件中,注射劑均佔據一半以上的比例。
《報告》雖未點明產生不良反應的具體中藥注射劑名稱,但在2017年,《報告》顯示藥品不良反應/事件的中藥注射劑報告數量排名前5位的是理血劑、補益劑、開竅劑、清熱劑、解表劑。
作為一名中醫的蔣健向記者解釋道,傳統中藥幾千年來均以煎藥、口服的方式,近代中醫藥的現代化提出了靜脈給葯。靜脈給葯見效快、療效大,但注射劑在提取過程中,可能會有雜質混入,經注射進入血液後,發生不良反應的概率也相應增大。
隨著長期的臨床觀察應用,不同中藥注射劑的不良反應被逐漸發現。國家葯監局修訂後的說明書中,「不良反應」項被要求添加大量內容。以常被用來治療呼吸道感染的清開靈注射劑為例,其「不良反應」項應包含過敏反應、全身性反應、呼吸系統、心血管系統、消化系統等。
「許多大牌西藥,年年都有說明書的更新,反而是我們自己民族的中成藥,不太注重更新說明書,這(更新說明書)也是很正常的現象。」史錄文說。
值得注意的是,多款中藥注射劑均被禁用於兒童。事實上,兒童群體是注射劑不良反應的「重災區」。《報告》顯示,2017年兒童藥品不良反應/事件報告涉及的藥品劑型分布中,注射劑佔83.5%,明顯高於總體報告中注射劑的構成比。
「兒童藥量如何掌握是個問題,一般藥物的臨床試驗不會拿兒童來做,成人的評價指標又不能套用於兒童。」蔣健表示。
「由於兒童臟器發育尚未完全,對藥物更為敏感,耐受性較差,兒童注射用藥風險值得關注。」國家葯監局在《報告》中分析稱。
下半年啟動注射劑再評價
近期被監管部門點名要求修訂說明書的中藥注射劑,擁有相當可觀的市場規模。7月3日國家葯監局要求修訂說明書的清開靈注射劑,是年銷售收入過億的中成藥大品種。
史錄文認為,對注射劑增加「嬰幼兒、孕婦禁用」等人群限制,或對其使用量有所影響。但提高用藥對象的準確度或許還能擴大銷量,關鍵要看藥品是否具有可替代性。
不過,中藥注射劑被限制使用已是不爭的事實。2017版國家醫保目錄中,多款中藥注射劑受到限制。清開靈、雙黃連、魚腥草等注射劑均被限在二級及以上醫療機構使用,部分中藥注射劑只有重症患者方可使用。而此前在基層,中藥注射劑被大量使用。另外,已有省份開始對部分中藥注射劑進行重點監控。
2017年10月,中共中央辦公廳、國務院辦公廳正式印發《關於深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,明確根據藥品科學進步情況,對已上市藥品注射劑進行再評價,力爭用5至10年左右時間基本完成。上市許可持有人須將批準上市時的研究情況、上市後持續研究情況等進行綜合分析,開展產品成分、作用機理和臨床療效研究,評估其安全性、有效性和品質可控性。通過再評價的,享受仿製葯品質和療效一致性評價的相關鼓勵政策。
國家葯監局局長焦紅近日表示,2018年下半年要啟動藥品注射劑再評價工作。
蔣健告訴記者,不管是中藥,還是中國產的西藥,藥品說明書相比於國外的西藥簡單得多,原因就是藥品評價不夠細緻。不管是國家層面,還是醫生層面,都希望進行再評價。「關鍵在於,再評價的主體是企業,要充分調動企業的積極性。據我所知,目前還沒有一個法律規定哪些品種一定要進行再評價。葯企應主動尋找醫療機構,或CRO(合約研究組織)來做。」
關注東方財富網微信號【 eastmoneynews 】,每天為您推送權威、專業的財經資訊!歡迎在【應用商店】搜索【東方財富網】,下載中國財經第一門戶手機APPTAG: |