文丨April
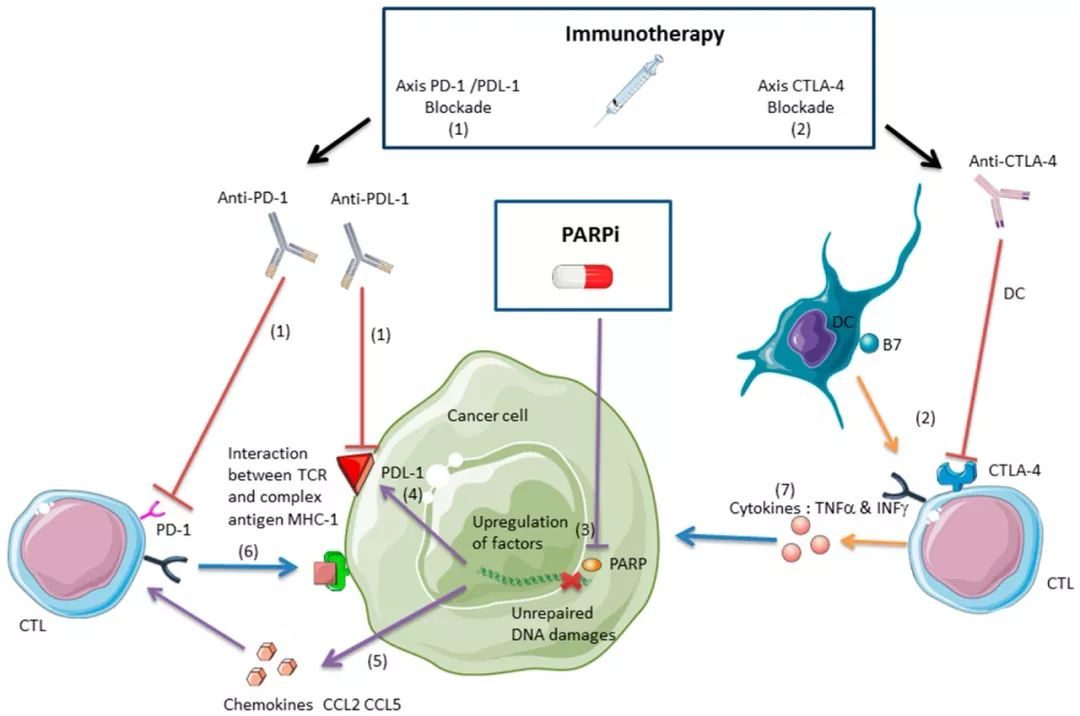
PARP,多聚ADP核糖多聚酶,在修復DNA單鏈斷裂(SSBs)中起主要作用,BRCA1或BRCA2兩個抑癌基因會使DNA雙鏈同源重組修復(HRD),這是腫瘤細胞具有兩種DNA損傷修復能力。 攜帶BRCA1或BRCA2基因突變的癌症患者體內的腫瘤攜帶著特定的DNA修復缺陷,因此對同樣能阻礙DNA修復的PARP抑製劑尤其敏感。合成致死簡單來講指的是,當兩種不同的基因或蛋白同時發生變化時會導致細胞死亡,而這兩種基因或蛋白中如果只有一種異常則不會導致細胞死亡。
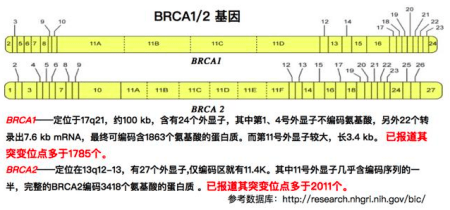
PARP酶在1963年首次被發現,接著發現BRCA1和BRCA2胚系突變能增加乳腺和卵巢癌的風險,直到2005年才確認BRCA1和BRCA2的突變對PARP抑製敏感性起重要作用。
首個進入臨床試驗的PARP抑製劑是輝瑞的AG014699,後來該葯賣給了Clovis Oncology,即為現在的Rucaparib。賽諾菲的iniparib在2011年進行了三陰乳腺癌III期臨床試驗,2013年鱗狀NSCLCIII期臨床和鉑耐葯卵巢癌II期臨床陸續失敗後宣布放棄開發。對PARP機制的質疑也隨之出現,直到2012年的一個研究顯示iniparib在臨床劑量不能抑製PARP,抑製活性比其他PARP抑製劑低約1000倍,和沒顯示靶點相關毒性,如骨髓抑製等,對機制的質疑才散去。
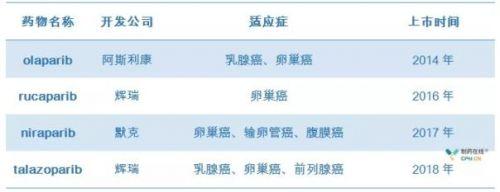
PARP抑製劑上市
Lynparza(Olaparib)作為首個上市的PARP抑製劑改變了一直以鉑類和紫杉醇為主化療法方案格局,特別是在BRCA胚系突變人群。同時,作為目前唯一在日本和中國批準的PARP抑製劑,在亞洲市場機會領先。
Rubraca (Rucaparib)相對於另外兩個抑製劑療效相當,安全性也沒有特別突出,最大的市場機會在單藥用於乳腺癌單葯。
Zejula (Niraparib)是首個被批準無需BRCA突變,用於經鉑類化療後腫瘤完全或部分收縮(完全或部分反應)的成人複發性上皮性卵巢癌、輸卵管或原發性腹膜癌的維持治療,這也是擴寬PARP抑製劑有效性的重要一步,但骨髓抑製毒性較另外兩個抑製劑更大。

晚期PARP抑製劑研發
在處於晚期臨床的PARP酶抑製劑中,輝瑞的talazoparib 和百濟神州的pamiparib含有PARP捕獲機制,PARP抑製劑能夠結合到PARP1(和/或PARP2)的NAD+結合口袋,造成構象異構,穩定了DNA-PARP的可逆解離,這個過程被稱為DNA-PARP複合物的「捕獲(trapping)」,相對於單純抑製PARP的催化活性,含有PARP捕獲機制的抑製劑會具有更高的有效性。

繼續探索更多適應症
2017年PARP抑製劑主要適應症在主要國家患病人數

BRCA1和BRCA2基因異常的女性一生患有卵巢癌的風險高達40%(BRCA1)或是20%(BRCA2)。BRCA1/BRCA2 突變在乳腺癌中佔2-3%,在三陰乳腺癌中佔超過10%,HER2-和三陰乳腺癌一直以來除了化療並無更好的選擇。儘管攝護腺癌是高度異質性,目前藥物治療方法還主要是激素療法,沒有分子或生物標記物相關的治療,15-20%的轉移性攝護腺癌有DNA修復缺陷,意味著可能會對PARP抑製敏感。
早期認為PARP抑製劑最好的生物標記物是胚系或體系BRCA突變,隨著研究繼續,同源重組缺陷有可能產生合成致死效應,誘導腫瘤細胞凋亡,這其中除了BRCA1/2, 還包括重要蛋白基因的突變,包括RAD51C, PALB2,FANCD2等,還有雜合性缺失(LOH)型同源重組缺陷,但目前還沒能辨識出突變基因。
乳腺癌和卵巢癌相對於其他PARP抑製劑潛在適應症中比較市場較小,胃癌,攝護腺癌等潛在人群市場更大,但也有可能受特殊基因型限制,比如家族性BRCA1/2 胚系突變胰腺癌就較為罕見,僅佔胰腺癌人群的5%,但若能發現其他類似相關同源重組修復突變基因,也許人群還能擴大。