▎葯明康德/報導
今日,美國FDA批準諾華(Novartis)的Kisqali(ribociclib)與芳香酶抑製劑(aromatase inhibitor, AI)聯合作為初始內分泌治療,用於罹患激素受體(HR)陽性、人表皮生長因子受體2(HER2)陰性晚期或轉移性乳腺癌的絕經前或後女性。FDA還批準Kisqali與氟維司群(fulvestrant)聯合作為初始內分泌治療或疾病進展後內分泌治療,用於罹患HR陽性、HER2陰性晚期或轉移性乳腺癌的絕經後女性。

值得一提的是,這是FDA作為在今年早些時候宣布的兩個新試點項目的一部分而授予的首個批準。這兩個試點項目為實時癌症審評(Real-Time Oncology Review)和新的模板化評估援助(Assessment Aid)。前者使FDA在臨床試驗結果正式提交前即開始審評;後者則方便申請公司用結構化的格式進行提交,加快FDA的審評。這些措施旨在使癌症藥物的研發和審評更加有效,同時改進FDA評估療效和安全性的嚴格標準。通過這種實時審評,FDA能夠在試驗結果出現後立即開始評估臨床數據,使FDA能夠在提交正式申請時做好批準的準備。
乳腺癌是美國最常見的癌症形式。美國國立衛生研究院(NIH)的國家癌症研究所(NCI)估計,今年將有大約266,120名女性被診斷為乳腺癌,其中40,920名將死於該病。大約72%的乳腺癌患者具有HR陽性和HER2陰性的腫瘤。她們需要有效的治療來緩解疾病。
本文來源:葯明康德
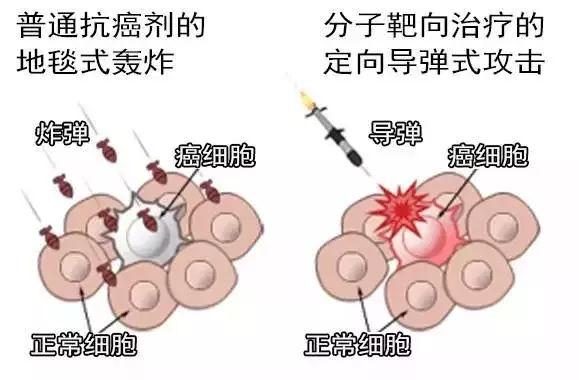
Kisqali是一種選擇性細胞周期蛋白依賴性激酶抑製劑,是一類通過抑製兩種細胞周期蛋白依賴性激酶4和激酶6(CDK4/6)來幫助減緩癌症進展的藥物。當這些蛋白被過度激活時,可使癌細胞生長和分裂得太快。以較高的精確度靶向CDK4/6有望避免癌細胞不受控制地複製。該藥物於2017年3月首次獲批與芳香酶抑製劑聯合治療罹患HR陽性、HER2陰性晚期或轉移性乳腺癌的絕經後女性。

▲Kisqali(ribociclib)是一種CDK4/6抑製劑(圖片來源:《Nature Reviews》)
Kisqali與芳香酶抑製劑聯合治療絕經前或後女性的療效在包含495名患者的臨床試驗MONALEESA-7中得到證實。該研究中的所有患者均接受了戈舍瑞林(goserelin)的卵巢抑製。結果顯示,與接受安慰劑加芳香酶抑製劑的患者相比,接受Kisqali加芳香酶抑製劑的患者的中位無進展生存期(PFS)更長(13.8個月比27.5個月)。
Kisqali聯合氟維司群治療晚期或轉移性乳腺癌的療效也在包含726名患者的臨床試驗MONALEESA-3中得到驗證。結果顯示,與接受安慰劑加氟維司群的患者相比,接受Kisqali加氟維司群的患者的中位PFS更長(12.8個月比20.5個月)。
「通過這項批準,我們已經證明了我們正在試用的審評癌症藥物新項目的一些好處,可以提高監管效率,同時加強數據評估的過程。這表明,通過智能政策的方法,我們可以在提高效率的同時提高流程的嚴謹性。這些新項目旨在減少一些可能增加審評時間和成本的行政問題,包括FDA的人員配置負擔。例如,通過在正式提交給FDA之前更早地分析數據,以及在結構化模板中評估提交的數據,我們可以更容易地更早識別在申請中缺少的可能延遲審評的關鍵分析或資訊,「FDA局長Scott Gottlieb博士表示:「經過今天的批準,FDA使用這些新方法使審核小組在實際提交申請之前開始分析數據,並幫助指導公司對頂線數據的分析,以梳理出最相關的資訊。這使我們在6月28日提交後不到一個月就批準了該療法,比目標日期提前了幾個月。」
[2] Novartis Kisqali? now first and only CDK4/6 inhibitor indicated in US as first-line therapy specifically for premenopausal women; and as initial therapy with fulvestrant in postmenopausal women
本文來自葯明康德微信團隊,歡迎轉發到朋友圈,謝絕轉載到其他平台;如有開設白名單需求,請在文章底部留言;如有其他合作需求,請聯繫[email protected]