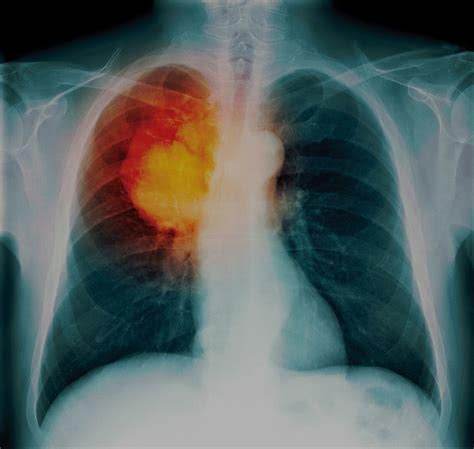
在中國,肺癌的發病人數和死亡人數都位居所有癌症的前列,並且,已經上市的藥物還遠遠不能滿足病人的需求。據統計目前全球有超過200種抗肺癌藥物處於臨床研究階段,綜合考慮治療效果、創新程度、銷售前景,新康界選取其中10個潛力最大的進行盤點,這些藥物包括了新型的小分子激酶抑製劑、免疫治療藥物、抗腫瘤疫苗、新靶點的抗體偶聯藥物,其中也包含了一些國產藥物。

10
Canakinumab
Canakinumab是一種人源化單克隆IL-1beta特異性抗體,對其他IL-1家族沒有結合能力,IL-1?是一個重要的調節免疫系統的蛋白,活性過高可導致自身免疫紊亂,進一步可能導致動脈粥樣硬化等心血管問題。此葯已經被批準治療多種自身免疫疾病,2017年8月舉行的歐洲心臟病學會(ESC)上發布的Canakinumab抗炎血栓形成的結果研究(CANTOS)讓人們看到此葯預防治療肺癌的潛力。一項探索性分析顯示,服用此葯後肺癌發病率及死亡率顯著降低,在中位數為3.7年的隨訪後,肺癌的發生率降低了67%,而癌症死亡率的明顯劑量依賴性風險降低,達到了藥物劑量最高的51%。炎症普遍被認為和癌症的發生和發展有著密切的關聯,這項臨床研究結果有力的證明了這種觀點,同時,為人們提供了一種全新的潛在的癌症預防和治療的方法。目前諾華已經遞交申請,正式啟動專門評估Canakinumab預防肺癌風險的3期臨床試驗。
09
PlinabulinPlinabulin是萬春藥業(BeyondSpring)開發的一種免疫治療藥物,它是一種鳥嘌呤核苷酸交換因子(GEF-H1)激活劑,通過激活GEF-H1導致蛋白質c-Jun的活化。激活的c-Jun進入樹突狀細胞的細胞核,上調免疫相關基因,進而激活一系列相關基因,促進樹突細胞(DC)成熟、T細胞活化和預防中性粒細胞減少。臨床前研究中已經顯示,Plinabulin可防止由不同抗腫瘤機制的化療藥物引起的中性粒細胞減少。2018年的ASCO-SITC臨床腫瘤免疫學研討會上,萬春藥業公開了Plinabulin多項研究的積極數據,其中一項全球2/3期臨床試驗研究共募集了55例晚期或轉移性非小細胞肺癌患者。試驗結果顯示Plinabulin(20毫克/平方米)與Neulasta相比,對嚴重中性粒細胞減少症的持續時間(DSN)非常相似,4級中性粒細胞減少的發生率幾乎相同(15%比14%)。Plinabulin目前已經開始準備進入III期臨床試驗,此外,還將進行與PD-1抑製劑以及CTLA-4抑製劑等免疫治療藥物聯用的研究。
08
Ensartinib
Ensartinib是由貝達葯業控股子公司Xcovery HoldingCompany LLC開發。Ensartinib是新一代ALK(Anaplastic Lymphoma Kinase,間變性淋巴瘤激酶)抑製劑,ALK是一種受體酪氨酸激酶,與血液、間質和實體三大類型腫瘤相關。體外研究有發現此葯對MET、LTK、ROS1和SLK等也有抑製作用。體外細胞研究發現Ensartinib的抑癌能力是傳統ALK抑製劑的10倍,而且對於導致克唑替尼耐葯的L1196M和C1156Y突變,Ensartinib也表現出較強的抑製活性。最近披露的臨床研究結果顯示Ensartinib對於未經ALK靶向治療的患者可達80%的有效率,無進展生存時間為26.2個月。目前Ensartinib正在進行國際多中心III期臨床研究。
07
AC0010馬來酸艾維替尼
馬來酸艾維替尼是由艾森醫藥研發的第三代EGFR抗腫瘤靶向抑製劑,用於治療具有EGFR突變或耐葯突變的非小細胞肺癌,2014年9月獲得中國CFDA和美國FDA的臨床研究批件;2015年艾維替尼分別在中國和美國啟動Ⅰ臨床研究,成為第一個進入中國臨床研究並同步開展美國臨床研究的自主創新藥物。至2016年初,在中國完成了I期臨床評估,收穫了預期效果,2016年8月25日,馬來酸艾維替尼獲CFDA Ⅱ/Ⅲ期臨床批件,獲得CDE的書面支持,確定了有條件批準的註冊臨床方案。美國的臨床研究也在包括國際上最大的癌症研究中心——美國安德森癌症中心(MD Anderson Cancer Center)在內的四大癌症中心啟動,AC0010的臨床Ⅱ/Ⅲ期研究預計將在2017年完成,但截止目前艾森醫藥方面還沒公布臨床研究結果,也讓人對此葯的前景產生了疑問。
06
Avelumab
Avelumab是一種靶向PD-L1的人源性Ig-G1單克隆抗體,為默克、輝瑞及禮來共有,在美國已獲批用於治療轉移性Merkel細胞癌以及晚期膀胱癌,實際上它最初被開發用於NSCLC的治療,在PD1抗體Opdivo, Keytruda相繼被批準治療NSCLC的情況下,人們有理由相信PD-L1抗體也可能獲得相似的治療效果。實際上早期的研究結果支持人們這種想法:Avelumab在一項名為JAVELIN研究早期臨床研究中,結果顯示中位隨訪13周,Avelumab的ORR為22.4%,中位無進展生存期(PFS)為17.6周。但是好景不長,2018年2月默克/輝瑞宣布avelumab的III期JAVELIN Lung 200研究未能到達主要終點:Avelumab作為二線療法相比多西他賽未能顯著改善PD-L1陽性(PD-L1表達水準≥1%)患者的總生存期(OS)。不過值得安慰的是,對於PD-L1高表達(≥50%,佔入組人數40%)和PD-L1強表達(≥80%,佔入組人數30%)的患者,Avelumab對OS的改善效果優於多西他賽。因此有理由相信默克/輝瑞將會改變臨床研究方案,繼續推進Avelumab在肺癌方面的應用。
05
Dacomitinib
Dacomitinib是輝瑞開發的一種第二代泛-人類表皮生長因子受體(pan-EGFR)酪氨酸激酶抑製劑(TKI),與第一代TKI相比第二代的優勢在於一步促進藥物與EGFR網路形成共價結合,從而不可逆地、完全中斷信號傳導,帶來持續且廣譜的抗癌活性。2018年4月FDA已受理Dacomitinib的新葯申請,用於攜帶EGFR激活突變的局部晚期或轉移性非小細胞肺癌(NSCLC)患者的一線治療,FDA針對此次申請授予了優先審查資格。此次提交申請是基於一項關鍵性III期臨床研究ARCHER-1050的積極數據。研究數據顯示,採用雙盲獨立中央審查,與Gefitinib治療組相比,Dacomitinib治療組無進展生存期(PFS)實現了統計學顯著和臨床意義的延長(14.7個月 vs 9.2個月)、死亡或疾病進展風險顯著降低了41%,達到了研究的主要終點。今年ASCO年會上,輝瑞又公布了ARCHER 1050的第二個終點,數據顯示,Dacomitinib組的中位OS為34.1個月,相較對照組的26.8個月,改善超過7個月。在30個月時,Dacomitinib組的生存率為56.2%,而對照組為46.3%。這些數據大大增加了Dacomitinib最終獲批的可能性。
04
Lorlatinib
Lorlatinib(洛拉替尼)是輝瑞公司開發的一種新型、可逆、強效ATP-競爭性小分子ALK和ROS1抑製劑,其對ALK已知的耐葯突變均具有很強的抑製作用,被稱為第三代ALK抑製劑,比起現有的ALK抑製劑,Lorlatinib潛在的優勢在於血腦屏障通透性更高,且對TKI耐葯的ALK突變的治療效果更好。2017年4月,Lorlatinib被FDA授予突破性藥物資格,用於既往接受過一種或多種ALK抑製劑治療,治療後疾病進展的、ALK陽性、轉移性NSCLC。這一資格的授予是基於一項正在進行的1/2期臨床研究的療效和安全性數據:在41例患者接受Lorlatinib治療的ALK陽性患者中總應答率為46%,3例患者實現完全應答,16例患者實現部分應答,中位PFS為11.4個月,2017年10月,輝瑞公布了Lorlatinib的Ⅱ期臨床試驗完整數據,實驗結果顯示該藥物在治療ALK陽性和ROS1陽性的晚期NSCLC患者的肺腫瘤和腦轉移上顯示出有臨床意義的活性。目前III期臨床研究正在進行中。
03
TG4010
TG4010是法國生物公司Transgene開發的一種治療性抗腫瘤疫苗,它的本質是一種編碼MUC1腫瘤相關抗體和白細胞介素2(IL-2)的重組修飾牛痘病毒的懸濁液,其中MUC1能夠提供抗原刺激介導細胞應答,同時病毒載體用來增加免疫應答。2017年4月BMS與Transgene達成臨床合作協定,雙方將進行Opdivo(Nivolumab)聯合TG4010疫苗及標準化療一線治療低水準或陰性PD-L1的非小細胞肺癌的安全耐受及有效性評估研究試驗。該2期臨床研究的試驗目標包括腫瘤客觀緩解率、疾病的控制情況。另外,試驗還會評估組合療法的安全耐受性及其它療效指標達成情況。該項多中心、單臂試驗預計將在2018年取得前期數據。此次臨床項目的申辦人是Transgene,由於前期TG4010聯用化療的大型臨床2b試驗獲得了成功,Transgene對TG4010未來的臨床研究以及最終的批準上市都很有信心。
02
TPX-0005
TPX-0005(洛普替尼)是由TP Therapeutics公司研發的所謂的「第四代ALK抑製劑」。與之前的ALK抑製劑相比它有以下幾個優點:
1.廣譜性:同時抑製ALK、ROS1和TRK,可以針對包括ALK G1202R、ROS1 G2032R和TRKA G595R在內的多種突變。
2.TPX-0005的緊湊的小分子結構使它在ATP內部與中心結合位點有效結合,並且避免ATP結合位點之外的突變造成的太空位阻,即避免臨床耐葯突變的干擾。
3.TPX-0005的分子比現有的所有ALK和ROS1抑製劑分子量更小,很可能具備不弱於Lorlatinib的強大穿透血腦屏障能力。
2017年6月,FDA授予TPX-0005孤兒葯資格,用於治療攜帶ALK、ROS1或NTRK致癌基因重排的NSCLC患者。TPX-0005目前正處於1/2期、開放標籤、多中心臨床研究試驗階段,在ALK、ROS1或NTRK1-3重排突變晚期實體瘤患者群體中評估安全性、耐受性、葯代動力學和抗腫瘤活性。
01
Rova-T
Rova-T是一種抗體偶聯藥物,全名Rovalpituzumab tesirine,靶向一個叫做DLL3的蛋白。DLL3在包括小細胞肺癌的多種腫瘤中都有表達,相對於非小細胞肺癌(NSCLC),小細胞肺癌(SCLC)更加難治,研發中的新葯更少,最近30年沒有突破性的藥物。因此,Rova-T 的出現讓人們看到大幅度改善SCLC預後的希望。Rova-T是艾伯維從Stemcentryx收購獲得,收購總價格達到了驚人的98億美元,包括一次性支付58億美元,以及40億美元的裡程碑支付款。如此高的收購價格在縱觀整個製藥行業都非常罕見。2016年6月公布的臨床數據也頗符合人們的高預期:對小細胞肺癌的臨床有效率高達38%,臨床獲益率高達89%;然而2018年3月份公布的三線小細胞肺癌研究的中期結果卻遭遇了滑鐵盧,有效率僅為16%,遠低於40%的預期,這也使得艾伯維放棄了FDA的加速批準計劃。不過艾伯維方面依然有信心,他們相信Rova-T作為SCLC患者一線或二線療法或能帶來令人滿意的結果,同時Rova-T作為其他DLL3突變腫瘤患者的研究也在進行中。

2018年上半年中外醫健合作趨勢及案例分析
點擊上圖閱讀文章