記者 | 謝欣
編輯 | 任悠悠
1
11月13日,界面新聞獨家獲悉,國家藥監局藥品審評中心(CDE)已結束百濟神州PD-1替雷利珠單抗注冊申請的技術審評工作,並已在11月13日報送國家藥監局進行審批,品種技術審評建議結論為“批準生產”。
按照審評審批流程,結束技術審評後,替雷利珠單抗下一步將進入文件製作與中心審核簽發的環節,這意味著替雷利珠單抗已進入最後的行政審批階段,獲批上市在即。
同時,在CDE的“補充資料任務隊列”中,根據受理號查詢替雷利珠單抗顯示無結果,應已離開了審評隊列。
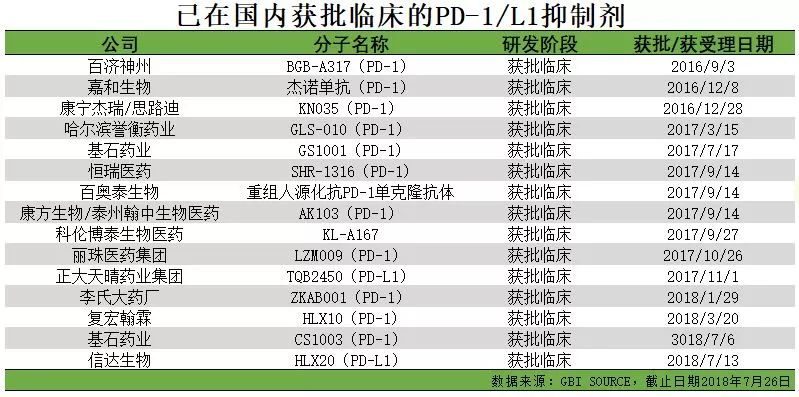
替雷利珠單抗提交的適應症為複發/難治性經典霍奇金淋巴瘤(cHL),此前已被納入優先審評。替雷利珠單抗也將成為國內第6款獲批的PD-1,同時也是第4個獲批的國產PD-1產品。
同樣也是在今天(11月13日),2019年國家醫保談判藥品部分進入第三天,4個在2019年前獲批的PD-1將與國家醫保局進行談判。從市場上看,信達生物的信迪利單抗注射液(達伯舒)2019上半年銷售收入3.32億元;君實生物特瑞普利單抗注射液(拓益)銷售收入3.08億元;而默沙東K藥在國內上市一年後銷售額已突破20億元。
替雷利珠單抗還已在國內提交用於治療先前接受過治療的局部晚期或轉移性尿路上皮癌(UC)的適應症申請,預計將於2020年獲得上市批準。
目前替雷利珠單抗還在開展包括一項針對二線或三線非小細胞肺癌(NSCLC)患者的3期臨床研究、一項針對一線肝細胞癌(HCC)患者的3期臨床研究、一項針對二線食道鱗狀細胞癌(ESCC)患者的3期臨床研究、一項針對一線胃癌(GC)患者的3期臨床研究、一項針對一線ESCC患者的3期臨床研究、一項針對二至三線HCC患者的2期臨床研究