記者 | 謝欣
編輯 | 許悅
1
據上觀新聞1月24日晚報導,上海之江生物科技股份有限公司研發的2019新型冠狀病毒核酸檢測試劑盒今天通過了上海市醫療器械檢測所的檢驗,成為我國法定檢驗機構檢定合格的首個新型冠狀病毒檢測產品。
但目前之江生物僅僅是完成了送檢,尚未正式獲批上市,後續流程仍未走完。
獲得國家藥監局的上市批件後,這種試劑盒將被發往各地醫院、疾控中心和出入境檢驗檢疫局,用於測定疑似患者的樣本中是否有新型冠狀病毒。
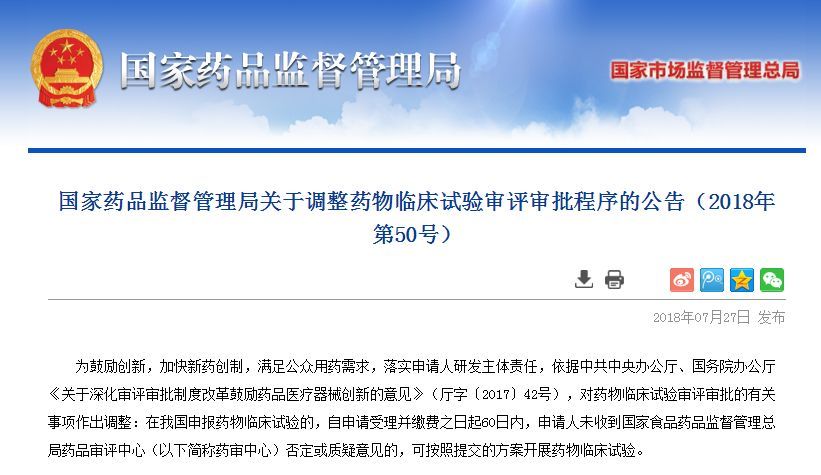
由於目前所研發出來的新型肺炎病毒檢測試劑盒都還未正式獲批上市,按照相關法規無法進入地方醫院銷售,這也是目前各地新型肺炎病毒檢測試劑盒緊缺的一個重要原因。但這種局面將在快速審批通道開啟後得到改變。
根據報導,全國共有7家企業研發的新型冠狀病毒核酸檢測試劑盒進入了國家藥監局快速審批通道,包括此前國家衛健委確認供應的伯傑醫療、捷諾生物和輝睿生物。
據了解,這次開通的綠色審評審批通道主要是將審批模式改為了平行審批,此前一般按順序依次進行的多個注冊流程目前可以同步進行,這將大大縮短注冊時間。
一般來說,這些流程包括報送研究資料、臨床實驗數據分析、對企業生產體系現場檢查等7、8個步驟。
而本次最大亮點在於,在臨床試驗數據這部分,國家藥監局將允許使用真實世界數據進行注冊,“必須有真實(世界)數據而且要有一定數量的陽性樣本,這次最主要就看臨床數據,以前最主要看體系、數據和研發規範”,一位知情人士對界面新聞記者透露。
而使用真實世界數據支持注冊也是符合目前新冠狀病毒感染的肺炎的疫情發展。由於傳統的隨機臨床試驗耗時長,但眼下情況緊急,而作為三類醫療器械的新型肺炎病毒檢測試劑盒在注冊時也必須保證質量水準,速度與質量兩者平衡之下,接受目前已有的真實世界臨床數據支持注冊幾乎是唯一合適的選擇。
但也有知情人士透露,當前情況下如何從醫院獲取真實世界數據,也會是一個難點。