在介紹眾多科研力量投入慢性B肝新藥開發之際,不得不提的既是RNAi這項前沿技術。RNA干擾是如何在治療慢性B肝研究藥物中脫穎而出的呢?我們先來了解一下,B肝病毒是如何複製的。

B肝新藥開發應用,基於抑製cccDNA形成,RNAi理論基礎
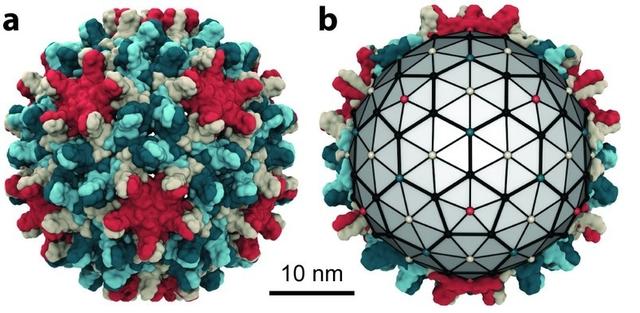
B肝病毒(HBV)的病毒粒子,或Dane顆粒,有大、中、小表面抗原嵌入周圍的包膜。核衣殼位於被膜內,由一個20面體衣殼組成,該衣殼通常由120個核心蛋白二聚體組成,帶有包裹的病毒松弛環狀DNA(rcDNA)和聚合酶蛋白。除了完整的感染顆粒外,B肝病毒感染者的血清中還含有大量的亞病毒顆粒,這些亞病毒顆粒主要由小的表面蛋白組成。
肝細胞感染由Dane顆粒與位於細胞表面的糖胺聚糖相互作用引起的。此後,肉豆蔻大表面抗原與牛磺膽酸鈉(NTCP)膽汁酸轉運體的特異性結合啟動了核衣殼的細胞進入。已有證據表明,表皮生長因子受體也可能在B肝病毒進入肝細胞的吸收中發揮作用。HBV的NTCP受體直到2012年才被發現,並為HBV複製研究提供了寶貴的動力。

在這一發現之前,全球研究人員由於缺乏關於B肝病毒如何在感染過程中,進入肝細胞的信息而阻礙了對B肝病毒的研究。在上一章節,小番健康已經初步介紹了RNA干擾(RNAi)激活劑對HBV生命周期的破壞機制,更深層的講,衣殼被調控分解後釋放出rcDNA,然後在細胞核內轉化為共價閉合環狀DNA(cccDNA)。修複過程包括使用宿主細胞酶,如酪氨酸DNA磷酸二酯酶2(TDP2)和皮瓣內切酶1(Fen1)。
將rcDNA轉化為cccDNA和建立HBV複製,是一個有效的過程。南非約翰內斯堡威特沃特斯蘭德大學健康科學學院病理學院抗病毒基因治療研究室研究人員介紹,在對黑猩猩和鴨子的動物模型研究表明,一個單一的感染粒子就足以引發複製病毒的感染。cccDNA是一種穩定的複製中間產物,作為編碼mRNAs的前基因組RNA(pgRNA)和病毒蛋白的轉錄模板。

維持感染肝細胞內cccDNA,是由HBx由X開放閱讀框(ORF)編碼的蛋白質)。染色體外DNA(如cccDNA)被5/6染色體(SMC5/6)複合體的細胞結構維持作為轉錄沉默的靶點。HBx與泛素連接酶1的受損DNA結合域相互作用,使SMC5/6不穩定,從而促進了HBV基因表達。cccDNA的orf排列在一個非常緊湊的組織中。蛋白質編碼序列相互重疊,多蛋白編碼通過使用不同的讀取幀來實現。
進一步增加緊湊的安排是嵌入調控元素,比如啟動子和增強子,在病毒性開放閱讀框。了解完整的cccDNA後,我們再來了解基於RNAi抗HBV治療的理論基礎。RNA分子,包括編碼病毒蛋白的pgRNA和mRNAs,對HBV複製至關重要。因此,破壞這些病毒序列的穩定性,被認為是滅活病毒的好策略。這種治療方法通過降解pgRNA,抑製cccDNA的形成。
此外,抑製對cccDNA形成很重要的病毒蛋白的翻譯,比如C和HBx,也會限制cccDNA的產生。HBV基因組的緊湊排列限制了序列的可塑性和逃避沉默序列的能力。此外,包含HBx的常見3′序列的存在,意味著不同的B肝病毒轉錄物可能被個體沉默序列所靶向,這就是當前全球研究人員推進基於RNAi開發慢性B肝新藥的理論基礎。

小番健康結語:以上RNAi抗HBV作用機制和cccDNA形成,發表在2020年8月4日科學雜誌《Viruses》(歸屬於抗病毒治療的RNA干擾專刊)(南非約翰內斯堡威特沃特斯蘭德大學健康科學學院病理學院抗病毒基因治療研究室)。返回搜狐,查看更多
責任編輯: