▎醫藥觀瀾/報導
2018年9月22日,德琪醫藥在中國廈門舉行的第21屆中國臨床腫瘤學會(CSCO)年會上公布在研口服ATG-010(Selinexor)聯合低劑量地塞米松(Sd)治療難治複發多發性骨髓瘤的2b期臨床研究、口服ATG-010(Selinexor)聯合硼替佐米和低劑量地塞米松(SVd)治療難治複發多發性骨髓瘤的1b/2期臨床研究、口服ATG-010(Selinexor)單葯治療複發瀰漫性大B淋巴瘤的2b期臨床研究的相關數據。
」對於易複發的五線多發性骨髓瘤和瀰漫性大B細胞淋巴瘤,中國患者亟需一種新的作用機制的創新療法,」德琪醫藥創始人、董事長、首席執行官梅建明博士表示,「ATG-010(Selinexor)已由我們美國合作夥伴Karyopharm完成用於治療五線複發多發性骨髓瘤患者(multiple myeloma, MM)新葯上市申請(NDA)的滾動遞交(rolling submission)。迄今為止,已有超過2600名患者接受了selinexor的治療。我們今天彙報在2b期STORM臨床試驗的積極的臨床數據,該研究評估了selinexor聯合低劑量地塞米松治療五線失敗的難治性多發性骨髓瘤的患者。我們也彙報了在2b期的STOMP臨床試驗,該實驗評估了selinexor聯合硼替佐米(Velcade?, bortezomib)和低劑量地塞米松治療多發性骨髓瘤,同時,3期臨床試驗(BOSTON)也正在進行。我們還彙報了把selinexor作為潛在主乾治療藥物用於治療瀰漫性大B細胞淋巴瘤的2b臨床試驗SADAL的數據。以上三組數據,充分說明Selinexor具有詳實的臨床研究的數據作為支撐,也說明我們美國合作夥伴Karyopharm在嚴謹的科學精神和前期的辛勤努力。」
報告發言人,德琪醫藥臨床藥理和生物統計副總裁楊軼君博士表示:「Selinexor能夠在大多數既往接受過5線而且大多是7線治療的多發性骨髓瘤患者人群裡依然能夠達到26.2%總體緩解率,以及在臨床獲益的患者人群裡中位生存期達到15.6個月。這樣的臨床結果令人鼓舞。」


▲德琪醫藥臨床藥理和生物統計副總裁楊軼君博士作口頭報告
「我們同德琪醫藥達成深度戰略合作後,今天非常榮幸能夠將STORM、STOMP和SADAL三個臨床試驗的關鍵數據在今年的中國臨床腫瘤年會上同中國的臨床腫瘤專家分享:」 Karyopharm公司創始人、董事長、首席科學官Sharon Shacham博士表示,「中國臨床腫瘤年會是中國最知名的腫瘤學會議,我們希望把這些重要數據呈現給本次大會,把selinexor向全球重要市場進行縱深推廣。」
關於德琪
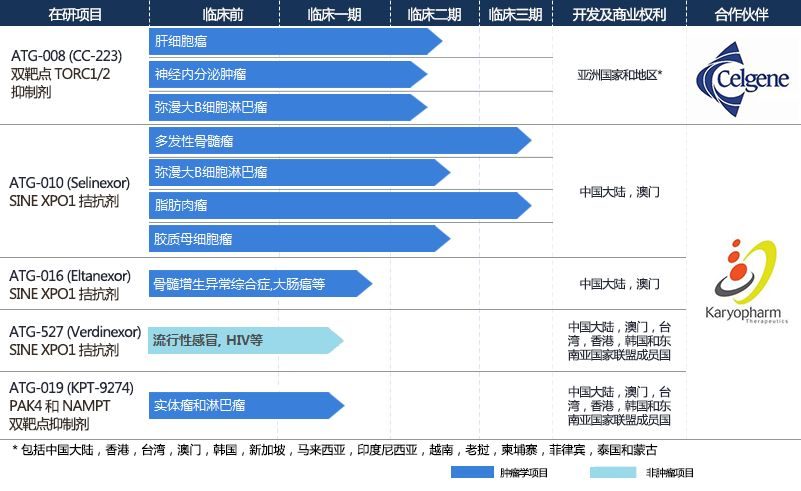
德琪醫藥是一家專註於新葯開發和銷售的創新葯公司,專註於解決亞洲地區未被滿足的醫療需求,並力爭為中國及亞太地區的患者提供最尖端和領先的抗癌藥物。2017年4月13日,全球創新葯長官企業新基葯業(Nasdaq:CELG)成為德琪醫藥的長期戰略合作夥伴併入股德琪。目前,德琪醫藥擁有五個臨床研發階段的產品:ATG-010是一款在多發性骨髓瘤(multiple myeloma, MM)、瀰漫性大B細胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)及多種實體瘤分別處於NDA申報及臨床二/三階段的在研產品;ATG-008已在包括中國大陸、中國台灣和韓國在內的多個地區展開亞太多中心肝癌臨床研究;ATG-016和ATG-019是兩款處於臨床一/二期的專註於癌症治療的在研產品,正在進行關於治療包括骨髓增生異常綜合征(myelodysplastic syndromes, MDS)、結腸直腸癌、攝護腺癌在內的多個癌症種類的臨床研究;ATG-527是一款在研抗病毒藥品,目前正在進行關於治療流感、呼吸道合胞病毒(respiratory syncytial virus,RSV)及人類皰疹病毒(epstein-barr virus,EBV)感染等相關疾病的臨床研究,其已完成1期臨床研究。
關於Selinexor (ATG-010)
Selinexor (ATG-010)是一款選擇性核輸出抑製劑(selective inhibitor of nuclear export, SINE),是全球首創的SINE口服抗癌藥物。Selinexor通過結合併抑製核輸出蛋白XPO1(也稱為CRM1)而起作用,並導致腫瘤抑製蛋白在細胞核中累積,從而重新啟動和放大其作為腫瘤抑製劑的功能,導致癌細胞中的細胞凋亡的選擇性誘導,同時很大程度上讓正常細胞免受損傷。迄今為止,超過2600名患者接受了selinexor的治療。在2018年4月,Karyopharm報告了2b期STORM臨床試驗的積極的臨床數據,該研究評估了selinexor聯合低劑量地塞米松治療五線失敗的難治性多發性骨髓瘤的患者。Selinexor已被授予多發性骨髓瘤的孤兒藥物的稱號以及快速審評通道資格。Karyopharm已啟動 selinexor用於治療五線複發多發性骨髓瘤患者 (multiple myeloma, MM)新葯上市申請 (New Drug Application, NDA) 的滾動遞交(rolling submission)。Karyopharm Therapeutics還計劃在2019年初向歐洲藥品管理局(EMA)遞交有條件的新葯上市申請(MAA)。此外,Selinexor也正在進行涉及多種癌症適應症的多項中期和後期臨床試驗,包括期臨床試驗聯合硼替佐米(Velcade?, bortezomib)和低劑量地塞米松治療多發性骨髓瘤的3期臨床試驗(BOSTON);以及把Selinexor作為潛在主乾治療藥物和其他已經批準的多發性骨髓瘤藥物合用的臨床試驗(STOMP)以及瀰漫性大B細胞淋巴瘤(SADAL),脂肪肉瘤(SEAL)和研究者資助的子宮內膜癌臨床試驗(SIENDO)等臨床試驗。另外還有多個1期、2期以及3期臨床試驗正在進行中或正在計劃中,這些試驗包括將selinexor與一種或多種已批準藥物結合使用用於治療多種腫瘤類型。
關於Karyopharm Therapeutics Inc.
Karyopharm公司(納斯達克上市代碼:KPTI)是一家專註於全球創新葯開發的生物醫藥公司。公司主要以選擇性核輸出抑製劑相關靶點進行創新藥物的開發,其開發的SINE化合物通過結合併抑製核輸出蛋白XPO1(也稱為CRM1)而起作用。公司的SINE化合物除了通過單葯及聯合用藥治療多種腫瘤外,也在神經退行性病變、炎症、自身免疫性疾病、病毒感染等多種疾病方面也表現出生物活性。Karyopharm由Sharon Shacham博士創辦,目前有多個藥物處於臨床試驗階段和臨床前研究階段。