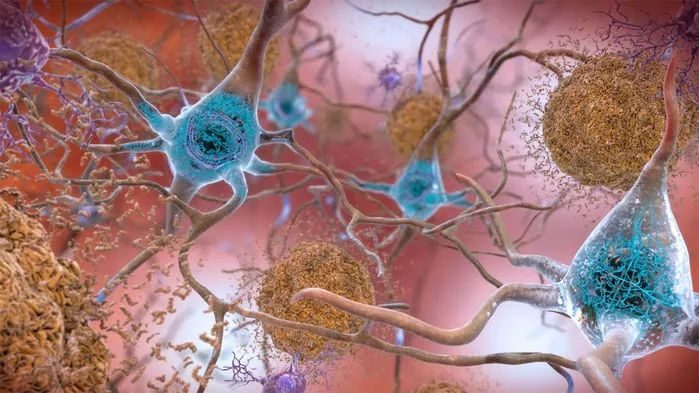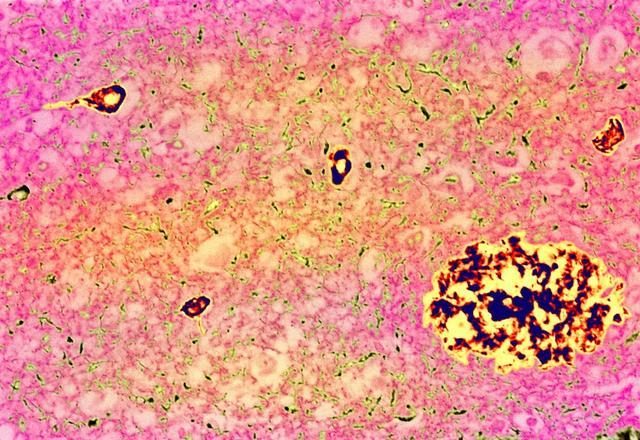

這種新葯減緩了認知能力的衰退,減少了澱粉樣蛋白斑塊,右下角是老年癡呆症患者的彩色微光圖。Credit
本周三,一項治療阿爾茨海默氏症的長期的令人沮喪的藥物研究達到了一個潛在的有希望的裡程碑。在一項大型臨床試驗中,這種藥物首次能夠減少患者大腦中的斑塊,並減緩癡呆症的發展。
要想知道這種新葯是否真的有效,還需要進行更廣泛的試驗,但如果周三在芝加哥阿爾茨海默氏症協會國際會議上公布的結果得到證實,這種藥物可能是第一個成功地同時攻擊大腦變化和阿爾茨海默氏症癥狀的藥物。

「這項試驗表明,你可以清除斑塊和改變認知,」波士頓布裡格姆婦女醫院(Brigham and Women』s Hospital)阿爾茨海默症研究與治療中心(Center for Alzheimer Research and Treatment at Brigham)主任瑞薩斯珀林(Reisa Sperling)博士說。「我不知道我們是否打出了本壘打。」重要的是不要過度總結數據。但作為概念的證明,我覺得這很令人鼓舞。
除了能延緩幾個月記憶衰退的幾種藥物外,目前還沒有有效的治療阿爾茨海默氏症的方法。阿爾茨海默症影響著全球約4400萬人,其中包括550萬美國人。據估計,到2050年,這一數字將增加兩倍。
這項試驗涉及來自美國、歐洲和日本的856名早期認知能力下降的患者。他們被診斷出患有輕度認知障礙或輕度阿爾茨海默氏癡呆,和所有重要的積累澱粉樣蛋白聚集成斑塊,患有這種疾病,林恩·克萊默博士說,衛材的首席醫療官,一家日本公司開發的藥物,稱為BAN2401,隨著生原體,位於劍橋的品質。


許多其他藥物已經成功地降低了澱粉樣蛋白的水準,但它們並不能緩解記憶力減退或其他認知障礙。在周三公布的數據中,五種新葯中最高的一種——每兩周注射10毫克的患者體重——都降低了澱粉樣蛋白水準,並且與服用安慰劑的患者相比,降低了認知能力的下降。
161名患者的劑量最高的那組,81%顯示這樣的澱粉樣蛋白水準顯著下降,他們「從澱粉轉換積極的澱粉樣蛋白-,」克萊默博士在一次採訪中說,這意味著病人的澱粉樣蛋白水準下降被認為是足夠高的關聯癡獃癡呆水準低於閾值。
在一系列認知和功能測試中,測量記憶力和計劃、推理等技能,高劑量組的表現下降的速度比安慰劑組慢30%。
斯珀林去年曾就另一種藥物向艾莎伊提供過短暫的建議,他稱澱粉樣蛋白的減少是「戲劇性的」,但他說,認知結果並不那麼重要。儘管如此,她說,「如果你真的能讓那些仍然正常或輕度受損的人減少30%,這在臨床上是很重要的。」

西奈山阿爾茨海默症研究中心的副主任山繆·甘迪博士說,要使這種藥物真正有效,就必須允許患者獨立工作更長時間,而不需要護理人員幫助他們進行基本的日常活動。這種實際應用並沒有反映在周三公布的數據中。
「我不會說這是一個量子飛躍,」他說。這是一個令人信服的針的移動。但目前尚不清楚,這枚針是否已經移動到足以改變人們生活的程度。
克萊默醫生說,在病人開始服用該葯18個月後,結果具有統計學意義,但大約6個月後,病情開始好轉。第二高劑量組的253例患者的澱粉樣蛋白和認知結果也有類似的趨勢。
在2017年12月,兩家公司報告說,對12個月的測試結果進行的統計分析顯示,該藥物不會導致癡呆癥狀的統計顯著減緩。這意味著試驗沒有達到它的主要基準,這導致一些專家和投資者對該藥物表示懷疑。儘管阿爾茨海默氏症協會發表了一份聲明,表達了謹慎態度,並表示研究結果「還不足以證明認知功效」,但18個月的研究結果緩解了一些懷疑。
研究結果來自第二階段的試驗,該試驗衡量藥物的安全性和有效性,但通常被認為是更大規模、更廣泛的第三階段試驗的中間步驟。其他藥物在第二階段已經顯示出希望,但在第三階段卻令人失望。
在這項試驗中,患者被隨機分為六組,247名患者接受安慰劑注射,而另外五組接受不同劑量的藥物。
審判的一個不同尋常的方面引起了一些專家的質疑。Eisai和Biogen使用了他們設計的認知評估。它被稱為阿爾茨海默氏症綜合評分(Adcoms),它借鑒了其他三種更成熟的認知測試的元素。
克雷默博士說,Adcoms的開發是為了從這三種測試中收集測量數據,這些測試足夠敏感,能夠在癡呆症的早期階段測量變化。周三公布的數據顯示,在三種已建立的檢測中,有兩種檢測結果是陽性的。
一些潛在的阿爾茨海默氏症治療已經導致嚴重的副作用,可能導致危險的腦腫脹或出血。這些公司報告說,服用這種新葯的患者中只有不到10%的人有過這種效果,因此相對安全。
這種藥物通過攻擊在粘附在斑塊上之前形成的粘稠的澱粉樣蛋白卷鬚起作用。這項試驗的結果為這個觀點提供了證據,即阿爾茨海默氏症的治療很可能在疾病的早期開始,因為它的大腦開始惡化,甚至在完全癡呆發生之前的幾十年。其他一些藥物失敗了,因為他們嘗試了老年癡呆症患者;另一些人在其進展的後期對澱粉樣蛋白進行了攻擊。


即使研究結果繼續呈陽性,使這種藥物在病人中廣泛使用也需要數年的時間。Kramer博士和Eisai的董事長兼首席執行官Ivan張說,這兩家公司最近提交了一份請求,要求與食品和藥物管理局(Food and Drug Administration)會面,了解他們需要採取哪些步驟才能獲得批準。
「現在談論這個問題還為時過早,但我們的目標是儘快將BAN2401帶給患者和家庭,」張說。
fda通常需要三期臨床試驗數據來證明安全性和有效性。不過,fda的一位發言人說,該機構確實有加快藥物審查的程式。這位發言人拒絕就該藥物或阿爾茨海默氏症藥物可能考慮的條件置評。
Eisai是Aricept的製造商,Aricept是為數不多的能幫助減緩早期記憶力衰退的藥物之一,但它的效果只有6到9個月。Biogen是另一種阿爾茨海默氏症治療藥物aducanumab的製造商,該藥物在減少澱粉樣蛋白和減緩認知能力下降的小階段1試驗中顯示出了早期的希望。阿爾茨海默病領域的許多人都在熱切地期待著aducanumab兩項大型臨床試驗的結果,預計將在2020年報告結果。
Gandy博士說BAN2401的結果對aducanumab的前景是令人鼓舞的,因為它表明至少有兩種化合物可以同時攻擊澱粉樣蛋白的堆積和認知能力的下降。
7月初,當兩家公司宣布將很快公布BAN2401試用的積極結果時,兩家公司的股價都上漲了約20%。從那以後,他們一直維持在這個水準。