這是我國福建廣生堂藥業在2022年歐肝會上發布的另一項B肝候選藥物 GST-HG141最新進展,並以題為:B肝病毒衣殼組裝調節劑GST-HG141在慢性B肝患者中的安全性、藥代動力學和抗病毒活性,發布在EASL2022。

B肝在研新藥GST-HG141,1b期快速強勁調降HBVDNA,pgRNA顯著下降
研究人員介紹,B肝病毒(HBV)衣殼組裝調節劑(CAMs)經過臨床驗證的慢性HBV藥物開發藥物,具有治愈HBV的潛力。先前已報導 GST-HG141是一種新型CAM,在健康受試者(臨床試驗編號:NCT04386915)中的安全性、耐受性和藥代動力學(PK)。本研究的目的是,評估多劑量 GST-HG141 在慢性B肝受試者(CHB)中的安全性、PK和抗病毒活性。
這是一項隨機、雙盲、多中心、安慰劑對照的多劑量遞增 1b期研究(臨床試驗編號:NCT04868981)。試驗對象為未接受干擾素或核苷治療(分別 > 12 或 > 6 個月)、B肝e抗原陽性或陰性(分別為血清HBVDNA≥ 2×10⁵ 或 ≥ 2×10⁴ IU/ml)的慢性B肝受試者,接受口服 BID劑量的 GST-HG141(20、50和100毫克),持續28天;
每個隊列中,有10名受試者被隨機分配接受研究藥物或安慰劑(4:1)。使用經過驗證的串聯質譜方法(LC-MS/MS)來量化血漿中的 GST-HG141。藥代動力學參數用WinNonlin 8.3軟體計算。採用實時熒光定量PCR (QuantitativeReal-timePCR)來檢測血清HBVDNA和HBV pgRNA,通過ELISA方法對血清HBV抗原進行測定。

結果表明,使用25毫克、50毫克或100毫克劑量下的 GST-HG141 BID給藥28天后,觀察到良好的耐受性。未報告嚴重不良事件(SAEs)或與劑量相關的不良事件(AEs)數量增加。沒有導致治療中斷的不良事件(TEAEs)。
觀察到血清HBVDNA水準的快速而強勁的下降(25毫克、50毫克和100毫克劑量組的中位數分別為 2.9、3.3 和 3.5 log10 IU/ml)。在所有劑量組中,血清HBV pgRNA水準下降中位數為 2.2 log10 U/ml,在治療第29天,100毫克劑量組中的最大中位數下降了 2.40 log10 U/ml。沒有發現任何病毒突破。
血清 HBsAg、HBeAg 或 HBcrAg下降,未觀察到有統計學意義。然而,在接受研究藥物治療的受試者中,血清HBeAg 和 HBcrAg呈下降趨勢。血漿GST-HG141暴露與劑量成比例增加。給藥28天后,觀察到中度蓄積(平均值 1.67-2.38)。
綜上所述,研究人員給出本研究結論是,口服 BID給藥 25毫克、50毫克或100毫克劑量下的GST-HG141,持續28天,具有良好的安全性和耐受性。它導致血清HBVDNA快速、穩健和劑量依賴性的下降。血清HBV pgRNA水準也顯著下降。血漿GST-HG141暴露幾乎與劑量成正比。GST-HG141用於CHB的進一步臨床開發是有必要的。2期研究與GST-HG141+核苷類似物的組合療法正在進行中。
來自福建廣生堂藥業B肝新藥開發管道
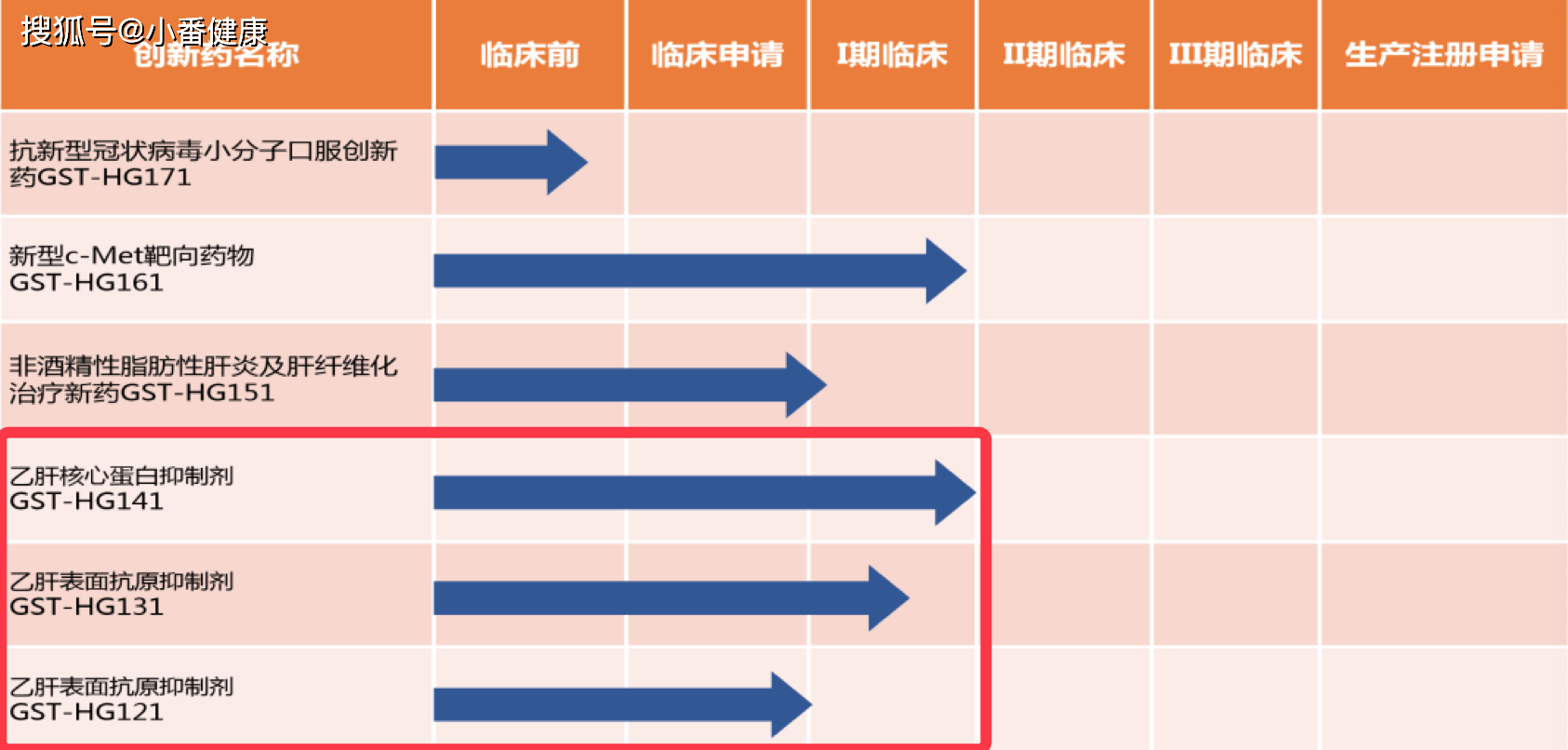
小番健康結語:這是福建廣生堂藥業在本屆歐肝會上帶來的另一份B肝創新候選藥物GST-HG141進展。該進展旨在說明,在一項1b期臨床試驗中,使用了研究藥物GST-HG141在慢B肝受試者中評估安全性、藥代動力學和抗病毒活性,結果顯示,使用 GST-HG141 以25毫克、50毫克或100毫克的多劑量遞增持續28天研究中,耐受性良好,未出現安全性信號;
有效性方面,觀察到血清HBVDNA快速強勁下降,血清HBV pgRNA也顯著下降。該1b期數據支持將 GST-HG141 繼續推進到第2期臨床試驗中。
在本屆歐肝會上,福建廣生堂藥業帶來的兩項新藥開發最新數據都是和GST-HG141有關,管道內其他兩種新機制B肝候選藥物的新數據並未出現在本屆歐肝會,主要是研究還在進行中。131的1期研究還在進行中,121剛剛獲批第1期臨床試驗批件,131和121都屬於B肝表面抗原抑製劑。從開發進展來看,福建廣生堂藥業的三種B肝候選藥物,GST-HG141的開發進度最快,目前已經是準2期中,131在1期,121新獲批1期批件。返回搜狐,查看更多
責任編輯:






