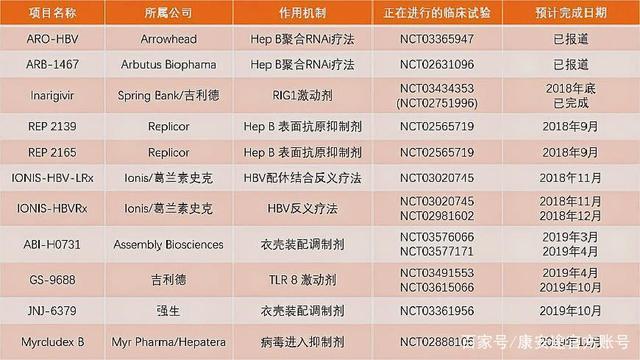
強生公司旗下揚生製藥子公司即將啟動一項4聯療法進行B肝新藥研發試驗。試驗最新發布時間為2020年6月19日。4聯療法是JNJ-73763989+JNJ-56136379+核苷類似物(NA)聯用或者不聯用聚乙二醇干擾素α-2a(PegIFN-α2a),用於治療e抗原陽性且丙氨酸氨基轉移酶(ALT)正常的B肝病毒感染者。
 圖片來源:美國臨床試驗數據庫
圖片來源:美國臨床試驗數據庫
B肝在研新藥4聯療法,首次納入e抗原陽性ALT正常,今年下半年啟動
最近,強勢公司旗下子公司楊生製藥將啟動一項B肝4聯用藥。其中,JNJ-73763989即前面曾經介紹到的基於RNAi干擾類藥物,採用皮下注射給藥的一種在研B肝新藥,又稱為JNJ-3989(ARO HBV);而另一種JNJ-56136379,屬於B肝病毒衣殼裝配抑製劑,除了這兩種藥物聯合使用外,還將聯用富馬酸替諾福韋二吡呋酯(TDF)以及一部分受試者增加聚乙二醇干擾素α-2a(PegIFN-α2a),從而形成4聯療法治療慢性B肝試驗。
具體試驗內容顯示為國際多中心的第二階段臨床試驗,主要評估上述4聯療法在e抗原陽性且轉氨酶水準基本保持正常,未接受任何治療慢性B肝感染者的安全性、有效性、耐受性以及藥代動力學。(目前試驗並未在國內招募受試者)

小番健康認為,結合本次試驗目的和選取受試者標準,可以看出本次試驗主要針對B肝病毒攜帶者,而並不是慢性B肝患者。納入標準為e抗原陽性、轉氨酶基本維持正常水準以及沒有接受過任何治療的B肝病毒感染者,因此,在這項試驗當中也詳盡解釋了,本次試驗是強生公司旗下兩種在研B肝新藥首次在B肝病毒攜帶者中,展開臨床試驗。
放眼全球B肝新藥臨床試驗,本次4聯療法適用在2019版《中國慢性B肝防治指南》中定義為慢性B肝病毒攜帶狀態下的主動聯合用藥試驗。試驗為期96周,在完成96周4聯用藥後,不需要繼續使用核苷類似物治療受試者當中,表面抗原血清學轉換率的佔比。試驗共分為4階段,JNJ-73763989是我國獲批開展臨床試驗的在研B肝新藥,已完成招募,預計將在本年完成並公布中國試驗者數據。

小番健康簡單介紹本次試驗目的。B肝病毒是一種以人體肝髒為宿主的小型脫氧核糖核酸病毒,當處於病毒感染急性期時,可以發展為2兩種情況,第一是自我免疫控制,即急性感染後的自愈;第二是由急性B肝發展為慢性B肝患者。目前,醫學界主流思路認為,針對慢性B肝患者的藥物治療,推崇B肝表面抗原血清清除率,簡單的講,這項若能夠徹底清除,即稱為功能性治愈。
但是,按照當下核苷類似物中恩替卡韋、替諾福韋酯以及干擾素,在長期合理用藥下,B肝表面抗原清除率依然比較低,大約僅為3%(數據來源本試驗)。而強生公司發起的4聯療法中,JNJ-73763989是通過干擾機制(RNAi),而JNJ-56136379為衣殼裝配調節劑,前面提到4階段分別是篩選、誘導、鞏固以及隨訪,通過JNJ-73763989+JNJ-56136379+TDF+PegIFN-α2a,評估安全性包括不良事件、實驗室、心電圖以及受試者的生命體征等。

小番健康結語:以上試驗共分4階段,預期納入80名受試者,並於第二階段評估4聯療法的安全性、有效性、藥代動力學。試驗預期開始時間是2020年9月14日,預期主要步驟完成時間是2023年4月14日,預期全部完成時間是2023年10月15日。上述4聯療法首次發布時間是2020年6月19日,尚未招募中。該試驗為國際多中心、開放標簽的隨機第二階段臨床評估JNJ-73763989+JNJ-56136379+TDF+PegIFN-α2a,但是,試驗並未在國內展開。返回搜狐,查看更多
責任編輯: