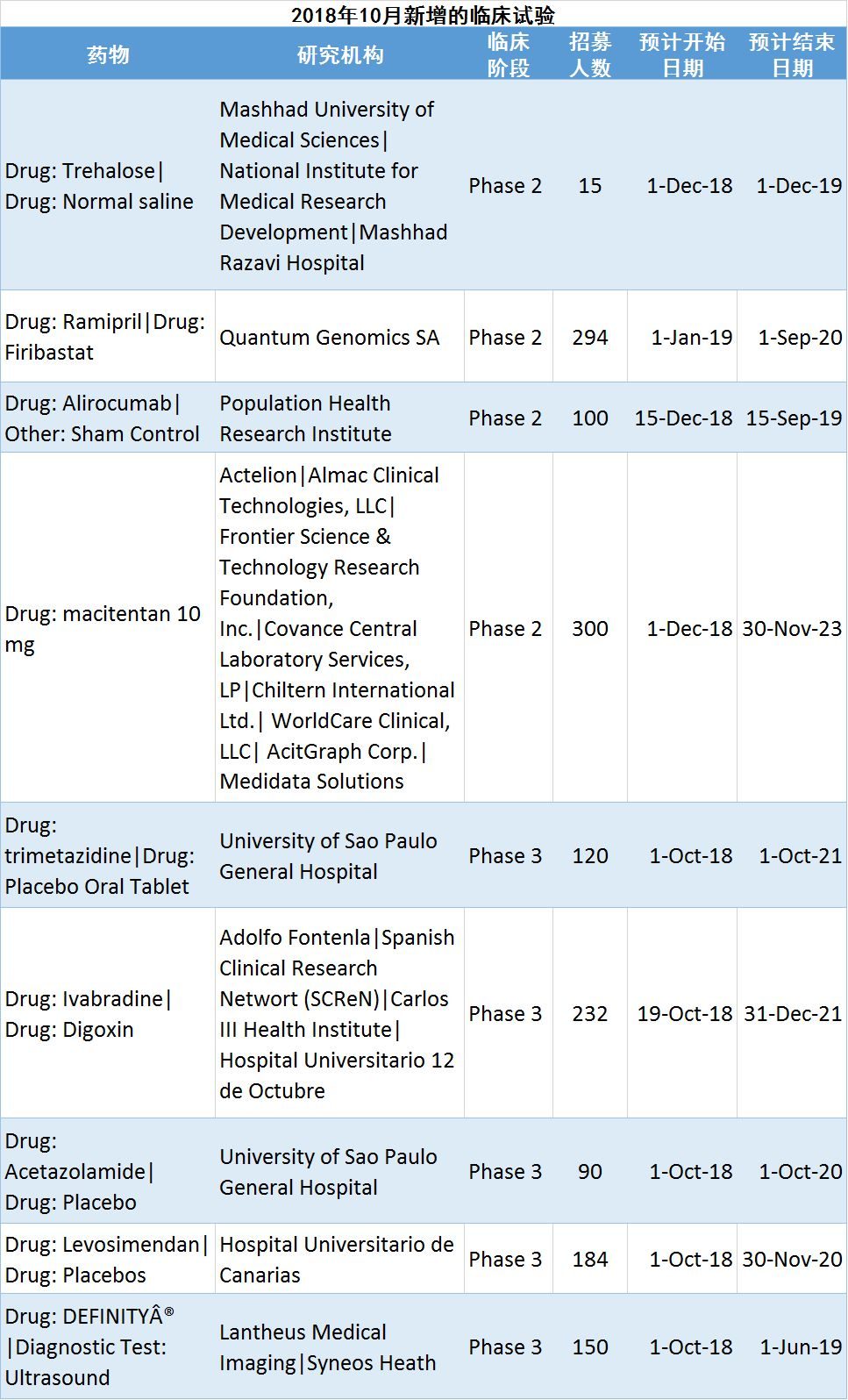
3月17日,一個全國乃至全球民眾都非常關注的消息橫空出世:重組新冠疫苗獲批啟動臨床試驗,首批試驗疫苗已經被接種到受試者的體內。除了關注疫苗能否順利通過“測試”、盡快上“戰場”外,大家還非常關心,這群勇敢的“試藥人”是誰,為什麽新藥試驗要先用在這些健康的人身上。接下來,就帶你了解下試藥這個古老的“職業”。
“試藥人”:我們很普通,也能承擔結果
中國臨床試驗注冊中心官網的公開信息顯示,軍事科學院醫學研究院生物工程研究所和一家生物公司注冊了重組新型冠狀病毒(2019-COV)疫苗(腺病毒載體)1期臨床試驗。這次試驗的目的是:評價18~60周歲健康成人接種重組新型冠狀病毒疫苗(腺病毒載體)的安全性和耐受性。
據媒體報導,經過篩選和體檢後,第一批志願者已完成新冠疫苗注射。
志願者被分為3組(低劑量組、中劑量組、高劑量組),每組36人,注射後將集中隔離觀察14天。這批志願者的招募條件是:僅限武漢常住居民,年齡18~60周歲。
接種後半年內,醫學團隊會定期對志願者進行多次隨訪,看是否有不良反應,以及體內是否產生抗S蛋白特異性抗體。

(圖片來源:中國臨床試驗注冊中心官網)
小米(化名)是這次新冠疫苗人體試驗志願者之一 ,她對媒體說:“我只是覺得自己剛剛好符合條件,沒有太多負擔,能承受結果,偶爾也想脫離一下低級趣味,真的該感謝的是所有一切站在普通人面前的人。”3月19日,小米在個人微博公布了自己做為志願者,接種了新冠疫苗。

(圖片來源:澎湃新聞微博)
武漢大學保衛部職工任超,也是這次疫苗臨床試驗的一名志願者,也已經完成了疫苗接種。任超說,目前他的身體狀況良好,雖然一開始也會害怕,但自己當過兵,相信科學家,也希望借此報答大家援助武漢的恩情。
任超介紹,接種疫苗後還需要隔離14天,每天要匯報身體數據,隔離結束後還要接受半年隨訪。

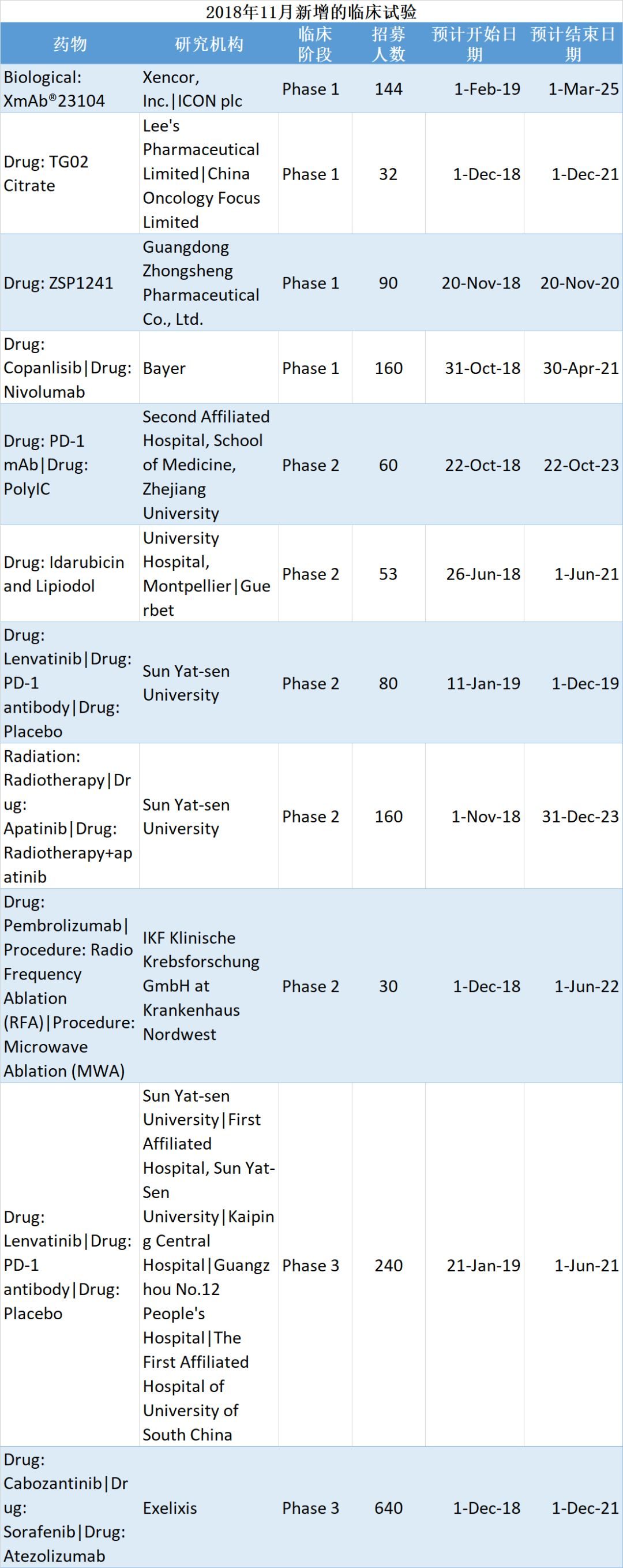
試藥這件事,由來已久
試藥,常規先在動物上進行,然後再在人類中進行,或者在相應疾病的患者中招募受試者,進行I期耐受性與安全性、劑量探索,I期結束後,在II期階段招募患者再次進行劑量探索與有效性試驗,III期階段招募患者,繼續觀察其有效性和安全性,IV期階段主要是藥物或者疫苗上市後觀察不良反應。這個是現代藥物上市的必經環節,也是一種易於引起倫理爭議的一項研究。
其實,在中國幾千年的歷史中,存在一種與臨床試驗非常相似的做法——“嘗藥”。比如,大家耳熟能詳的“神農嘗百草”、李時珍嘗藥,恐怕是最早的試藥故事了。
兩漢、魏晉南北朝時期:專職試藥人出現
試藥活動正式列入宮廷醫療制度,是在東漢時期(即公元1世紀末),專職試藥官出現了。
東漢的“嘗藥(監)”是中國歷史上首次出現專職試藥官職位,以口嘗的方式判斷藥性。“嘗藥監”一般沒有醫學背景,由宦官擔任。兼職試藥的小黃門、中常侍也均為宦官,這些人都是皇帝的親信,服務於皇帝。
這些試藥人服用的劑量,要顯著高於皇帝服下的劑量,所謂“過量十二”,即達到擬服用劑量的120%。然而,試藥人的健康狀況,沒有一個規範的規則,這種情況下的試藥,恐怕象徵意義大於實際意義,整體而言效度很低。
唐朝:試藥制度行政化
唐代是中國宮廷試藥制度史上的第二個高峰,這一時期奠定了此後歷代宮廷試藥制度遵循的基本架構。
唐代宮廷試藥活動有幾個特點:
第一,嚴肅、規範的集體政治活動。對於中央集權政權的穩定性而言,皇帝的健康狀況意義重大,宮廷試藥也因此被定性為國家政治事務,並牽涉內外廷的眾多官員及儲君。
第二,參與者按身份由低到高,包括:宮廷醫官、宮廷醫療主管官員、內廷主管官員、外廷文武長官、皇太子。程序繁瑣,分工細致,考慮周詳,並會注意留存檔案證據。醫官地位低下,專業色彩淡薄,在試藥活動中的地位也最為低下。試藥時醫官先嘗,各級主管和皇太子,意味著後者可以輕易質疑前者,甚至任意否定前者的工作。

(表1 《新唐書·百官志》所載唐代宮廷試藥制度)
明朝:繁瑣而無力的約束
明朝宮廷醫療涉及兩個機構——太醫院和內廷的禦藥房。
明朝試藥制度的特點:一是不牽涉外廷官員,成為內廷事務;二是程序設置極為精細。
最具代表性的是,藥物“一分為二”,也就是說,備藥時將擬用劑量加倍,備好後分成兩份,分別用於試藥人和病人。

(表2《明史·職官志》所載明代宮廷試藥制度)
清朝:逆專業化,醫生變為單一的診療服務提供者
清代宮廷醫療同樣由兩個機構共同負責——禮部下屬的太醫院和內務府下屬的禦藥房。
清廷試藥延續了明代的繁瑣制度和“一分為二”的設計。醫官先嘗,內監後嘗,後者對試藥結果有最終裁定權。
另一種出現於乾隆時期,太醫院禦醫徹底退出宮廷試藥,職責縮減為診斷和處方,而備藥和試藥由禦藥房全權負責。
這是一種奇特的“逆專業化”現象。專業人員從一種技術實踐活動中退出,而轉以行政官僚取代前者的角色,這與現代社會的專業化趨勢截然相反。醫生從兼任診斷、處方、備藥、試藥職責的綜合性治療者角色,變為單一的診療服務提供者。醫生的地位非但沒有提升,且日益滑向底層。
就全球而言,天花疫苗是試藥人對全人類的貢獻
天花是人類歷史上,第一個被疫苗消滅的傳染病。而天花疫苗的誕生,也離不開試藥人的貢獻。
18世紀末的歐洲飽受天花困擾。一次偶然的機會,英國醫生愛德華•詹納(Edward Jenner)發現,當地擠奶女工在給奶牛擠奶時,手上通常會長一些類似天花的“小水泡”,這種小水泡被稱為“牛痘”,是一種症狀比天花輕很多的疾病。並且,擠奶女工似乎極少感染天花。
詹納猜測,可能是女工的牛痘讓她們獲得了免疫力。為了驗證自己的想法,詹納從擠奶女工手上的痘痂裡取了一些膿液,接種給了一名8歲的男孩。男孩只是出現發燒,但是並無大礙。
最關鍵的一步是,詹納隨後給男孩接種了天花,而男孩並沒有發病。詹納由此斷定,輕微的牛痘感染可以避免嚴重的天花病毒感染,牛痘疫苗就此被發明出來,天花也被逐漸消滅。
可以說,沒有試藥的男孩,就消滅不了天花。

(天花病毒。圖片來源:站酷海洛)
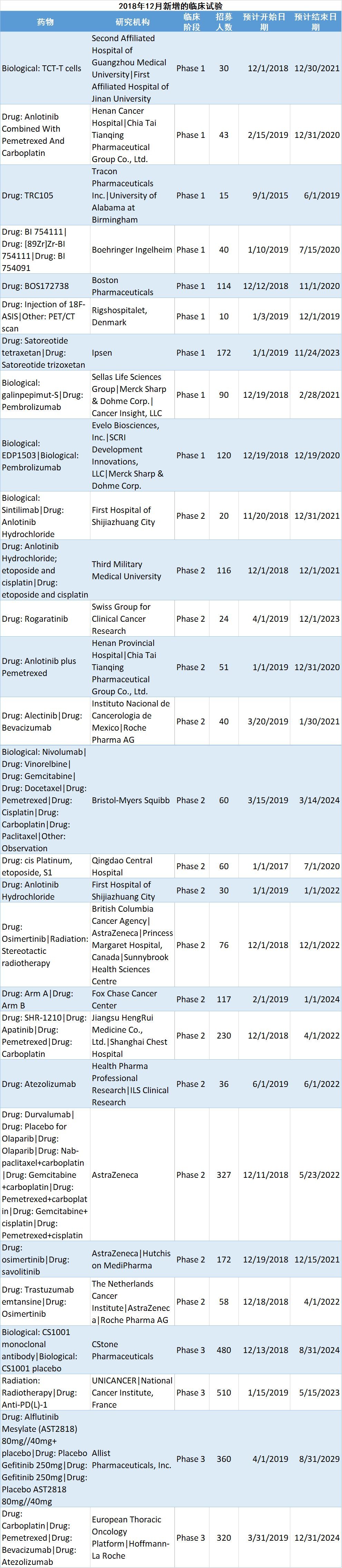
倫理規範下的藥物臨床試驗
取代傳統“試藥”
進入現代社會,針對新藥受試者的事件和保護,逐漸進入公眾視野。最著名的莫過於美國的“塔斯基吉梅毒試驗”。
從1932年開始,美國公共衛生署以免費治療梅毒為名,將500名完全不知情的非洲裔黑人當做試驗對象,秘密研究梅毒對人體的危害。實際上,這些受試者沒有得到任何治療。這一項目直到1972年被媒體曝光才終止。當時,參與試驗的患者中,已有28人直接死於梅毒,大約100人因梅毒併發症而死亡,40人的妻子受到傳染,19名子女在出生時就染上梅毒。
1964年公布的《赫爾辛基宣言》被視為臨床研究倫理道德規範的基石。其中規定:醫學研究只有在受試人群能夠從研究的結果中受益時才能進行。
上個世紀90年代初,世界衛生組織制定了《藥品臨床試驗規範指導原則》並向各國推薦。1998年3月,我國參照這一原則制定了《藥品臨床試驗管理規範》(試行);1999年底,修改後的《藥品臨床試驗管理規範》正式頒布;2003年9月1日又重新改版,更名為《藥物臨床試驗治療管理規範》(以下簡稱“規範”)。
根據新“規範”的規定,每一種新藥在正式上市使用之前,通常都必須經過動物和人體試驗。而人體試驗一般要經過四期。
近年來,中國的藥物臨床試驗項目劇增。數據顯示,我國每年有800多種新藥進行人體試驗,涉及人群約50萬人。單項研究涉及的受試者少則幾十名,多則上萬名。
試藥人有哪些保障?
如果有人想參加試藥,需要先填寫《知情同意書》,大致分為三部分:一是實驗項目內容介紹,二是“責任和權利”,三是對試藥的風險進行告知。
新“規範”明確了受試者應對有關臨床試驗的情況享有知情權,並規定了研究部門必須成立倫理委員會。其中提出:“受試者的權益、安全和健康必須高於對科學和社會利益的考慮”,並要求倫理委員會“向國家食品藥品監督管理局備案”的制度;必須“定期審查臨床試驗進行中受試者的風險程度”;明確規定“研究者在臨床試驗過程中,不得向受試者收取試驗用藥所需的費用”;“受試者參加試驗應是自願的,而且有權在試驗的任何階段隨時退出試驗而不會遭到歧視或報復……如發生與試驗相關的損害時,受試者可以獲得治療和相應的補償”。
僅僅做到上面這些還不夠,如果想參加試藥,要遵循已經制定好的臨床試驗方案,按照方案進行符合入組標準的招募。簽訂知情同意書後,需進行嚴格的體檢。體檢合格入組後,在統一的試驗地點封閉性管理,是為了保證受試者安全和試驗數據的準確性、科學性、原始數據可溯源性,試藥者準確的采血和飲食、作息等都會受到嚴格控制,並且需要定期接受隨訪和檢查,以評估藥物的療效與安全性。
目前,中國的 “試藥人”的構成較為複雜,最早基本上由學生、醫護人員、社會無職業者以及其他志願者、患者組成。目前越來越多的職業受試者加入試藥行列。通常,接受一次試藥後,常規3個月之內不得接受第二次以上試驗,每個試驗結束後,給與每個受試者一定的受試者補償費,具體數額是按照試驗的風險而決定。
除了1期臨床試驗通常招募健康人,後II-III期用患者試驗。在接受新藥物試驗的患者中,患者可能獲得治愈、延長生存或減輕痛苦的機會,這可能是當前常規治療無法獲得的。尤其是對一些惡性腫瘤以及目前還沒有很好的治療手段的疾病患者而言,參與新藥試驗往往意味著一線新的生機和希望。
試藥會對身體造成潛在的傷害嗎?
試藥會不會對身體造成潛在傷害呢?答案是有可能的。
根據國家藥品監督管理局官網公開的信息,我國現有藥物臨床試驗資質的機構約800家(去重後)。但即使是有資質的試藥機構開展的臨床試藥活動,儘管已經將試藥風險降到很低,但仍不能100%排除可能出現的不良反應、殘疾,甚至死亡的風險。出現這些意外情況該如何補償或維權,法律法規還有待進一步完善。

(圖片來源:國家藥品監督管理局官網)
總結來說,醫學不是萬能的,醫學是不斷發展的,新藥研發的過程也不是一蹴而就,整個流程機制有待進一步完善,這需要科研工作者、醫生、試藥志願者們、政府部門的共同努力。全民抗疫,勝利在望,感謝這些試藥志願者,期待國產的新冠疫苗早點用上臨床。
審核專家:
單愛蓮教授| 北京大學醫學部臨床藥理研究所
王月丹教授| 北京大學醫學部免疫學系
參考文獻
【主創團隊】
編輯:陳錚、張傑、張亮
排版:周舟
運營:張寧
統籌:張寧