1. 試驗藥物簡介
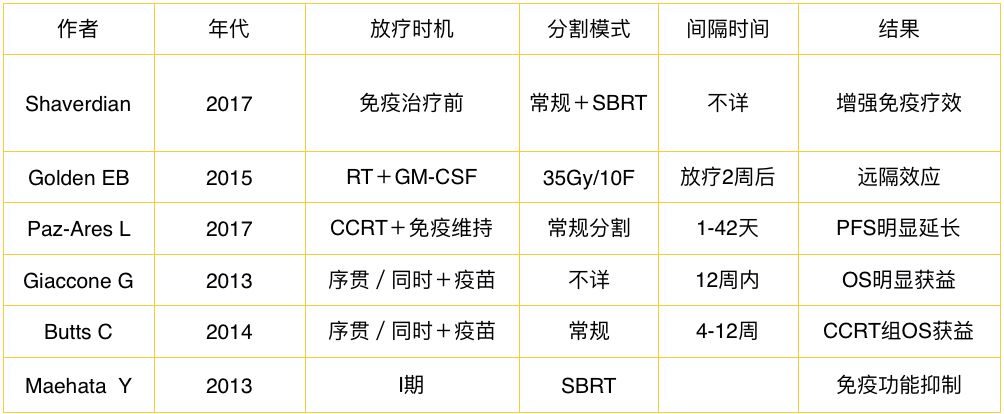
抗PD-1抗體(programmed death 1)程式性死亡受體1,是一種重要的免疫抑製分子。本試驗藥物是君實生物醫藥研發的JS001。
2. 試驗目的
初步評價重組人源化抗PD-1單克隆抗體注射液(JS001)治療晚期鼻咽癌的抗腫瘤活性
3. 試驗設計
試驗分類: 安全性和有效性
試驗分期: Ib/II期
設計類型: 單臂
隨機化: 非隨機化
盲法: 開放
試驗範圍: 國內試驗
4. 入選標準
1 對本研究已充分了解並自願簽署知情同意書(ICF)。
2 經組織學和/或細胞學確診的晚期和/或轉移性鼻咽癌患者。
3.既往接受過至少兩線針對晚期鼻咽癌的治療(包括但不限於抗腫瘤藥物治療或聯合放化療)且確定腫瘤進展或不耐受現有的其它治療方案;如果根治性手術伴隨的輔助或新輔助同步放化療結束後6個月內複發或轉移,可以入組本項研究。
4 至少有一個可測量病灶(根據RECIST 1.1);註:之前接受過放療的病灶不可以視為靶病灶,除非放療後病灶發生明確進展。
5 同意提供既往儲存的腫瘤組織標本或者進行活檢以採集腫瘤病灶組織送往中心實驗室進行PD-L1 IHC檢測。
6 年齡18歲~75歲,性別不限。
7 ECOG評分0-1分。
8 預期生存期≥3月。
9 入組前7天內實驗室檢查值必須符合相關標準。
10 入組前21 天內,育齡期女性必須確認血清妊娠試驗為陰性並同意在研究藥物使用期間以及最後一次給葯後28 天內採用有效避孕措施。本方案中育齡期女性定義為性成熟女性:1)未經歷子宮切除術或雙側卵巢切除術,2)自然停經未持續連續的24 個月(癌症治療後閉經不排除有生育能力)(即,在之前連續的24個月內的任何時間出現過月經)。
5. 排除標準
1 已知對一水枸櫞酸、二水枸櫞酸鈉、甘露醇、聚山梨酯過敏者(試驗藥物的組分)。
2 入組前4周內接受過抗腫瘤的細胞毒藥物治療、生物藥物治療(如單克隆抗體)、免疫治療(如白介素2或干擾素),或其它研究藥物治療。
3 入組前2周內接受過酪氨酸激酶抑製劑治療。
4 入組前4周內接受過放療,或8周內接受過放射性藥物治療,但針對骨轉移病灶的局部姑息性放療除外。
5 入組前4周內進行過外科大手術或尚未從之前的手術中完全恢復(外科大手術的定義參照2009年5月1日施行的《醫療技術臨床應用管理辦法》中規定的3級和4級手術)。
6 既往抗腫瘤治療的毒性反應尚未恢復到CTCAE[4.03版]0-1 級,以下情況除外:a.脫髮;b. 色素沉著;c.周圍神經毒性已恢復到<CTCAE 2級;d.放療引起的遠期毒性,經研究者判斷不能恢復。
7 具有臨床癥狀的中樞神經系統轉移(如腦水腫、需要激素乾預,或腦轉移進展)和/或癌性腦膜炎的患者。既往接受過腦或腦膜轉移治療,如臨床穩定已維持至少2 個月,並且已經停止全身性激素治療(劑量>10mg/天的潑尼松或其它等療效激素)大於4 周的患者可以納入。
8 鼻咽癌和頭頸部鱗癌患者入組前4周內檢查發現有壞死性病灶,研究者判斷有大出血風險。
9 入組前4周內接受過全身或局部的糖皮質激素治療。
10 既往或現在同時患有其它惡性腫瘤(除了得到有效控制的非黑色素瘤的皮膚基底細胞癌、乳腺/宮頸原位癌、和其它在過去五年內沒有治療也得到有效控制的惡性腫瘤)。
11 受試者存在任何活動性自身免疫性疾病或有自身免疫性疾病病史(包括但不限於:間質性肺炎、葡萄膜炎、腸炎、肝炎、垂體炎、腎炎、甲狀腺功能亢進、甲狀腺功能降低;患有白癜風或在童年期哮喘已完全緩解,成人後無需任何乾預的患者可納入;患有需要支氣管擴張劑進行醫學乾預的哮喘則不能納入)。
12 既往使用過抗PD-1抗體、抗PD-L1抗體、抗PD-L2抗體或抗CTLA-4抗體(或作用於T細胞協同刺激或檢查點通路的任何其它抗體)。
13 患有活動性肺結核(TB)的患者,正在接受抗結核治療或者篩選前1年內接受過抗結核治療。
14 患有需要長期使用免疫抑製藥物治療、或需要全身或局部使用具有免疫抑製作用劑量的皮質類固醇的合併症。
15 入組前4周內接種過任何抗感染疫苗(如流感疫苗、水痘疫苗等)。
16 妊娠或哺乳期婦女。
17 HIV陽性。
18 HBsAg陽性同時檢測到HBV DNA拷貝數陽性(定量檢測≥1000cps/ml)。
19 慢性丙型肝炎血液篩查陽性(HCV抗體陽性)。
20 研究者認為可影響方案依從性,或影響患者簽署知情同意書(ICF),或不適宜參加本臨床試驗的具有臨床意義的任何其它疾病或狀況。
6. 醫院和研究者資訊
主要研究者資訊

各參加機構資訊