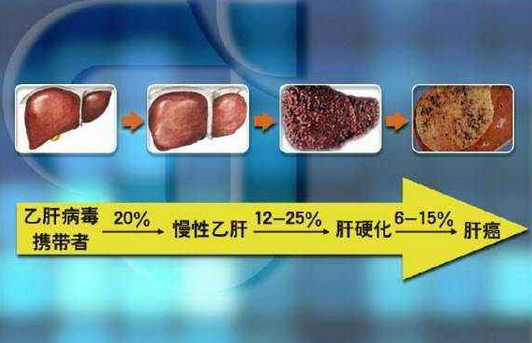
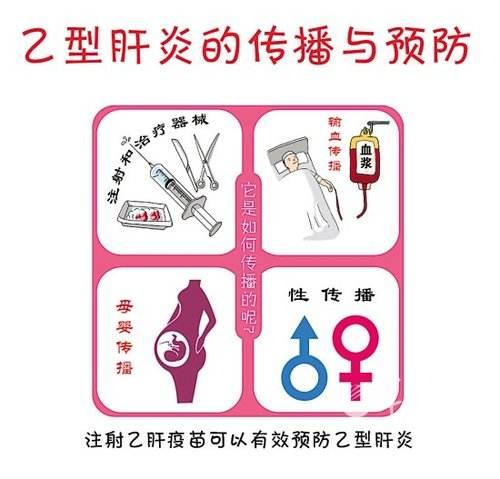
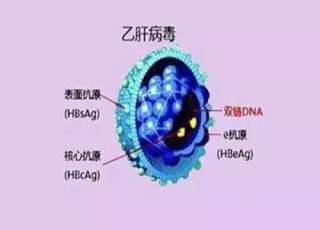
2020年8月11日首次發布並更新B肝在研新藥人體臨床試驗進展,試驗題目(英譯):中國大陸地區慢性乙型肝炎病毒2218的研究,登記於全球臨床試驗數據庫中,B肝在研新藥VIR-2218已在國內登記並批準臨床試驗(見下圖)。

B肝在研新藥VIR-2218,抑製全病毒蛋白表達,第2期啟動
見上圖,VIR-2218獲得臨床試驗默示許可,受理號:JXHL1900291,藥品名稱:VIR-2218注射液(ALN-HBV02),申請人名稱:騰盛博藥醫藥技術(上海)有限公司,適應症:用於治療非肝硬化成人患者的慢性HBV感染,注冊分類:1。本試驗為該藥在中國大陸地區的II期臨床研究,招募30名受試者,已於8月11日首次更新於全球臨床試驗數據庫,預計2020年8月開始,預計完成日期:2022年6月。
VIR-2218的II期臨床試驗由騰盛博藥醫藥技術(上海)有限公司(Brii Biosciences Limited)主辦,合作者:臨床階段免疫療法公司(Vir Biotechnology, Inc.)、阿里拉姆製藥公司(Alnylam Pharmaceuticals),臨床試驗編號:NCT04507269。試驗目的是,探討多重劑量VIR-2218在中國大陸成人慢性B肝患者中的安全性、藥代動力學和抗病毒活性(見第三圖登記信息)。

VIR-2218目前正在國內外開展臨床試驗,該B肝在研新藥採用皮下注射給藥,安慰劑對照生理鹽水注射。研究人員將主要關注結果指標是,最多48周時,CTCAE v5.0評估的因治療引起不良事件的受試者人數;最多48周時的生命體征、心電圖(ECG)和具有臨床意義的實驗室發現異常的參與者人數;次要結果指標是,最多24周治療時,PK:最大血漿濃度(ng/mL)、PK:達到最大血漿濃度的時間(h)、PK:血漿濃度-時間曲線下面積(ng*h/mL);
PK:從AUC最後到無窮大推斷的面積百分比(%);PK:表觀終末消除半衰期(h);PK:表觀血漿清除率(L/h);PK:表觀分布量(L);最多16周治療時,血清B肝表面抗原從基線水準最大程度降低;最多48周時,血清B肝表面抗原消失的受試者人數;最多48周時,血清B肝表面抗原持續消失大於或等於6個月的受試者人數;最多48周時,任何時間點B肝表面抗體轉為陽性的受試者人數;最多48周時,對e抗原陽性慢性B肝受試者:在任何時間點出現e抗原消失伴隨或不伴隨e抗體轉為陽性的受試者人數。

VIR-2218的中國大陸地區II期臨床研究入選標準:年齡18-65歲成人或老年人;體重大於或等於40公斤至小於或等於125公斤;慢性B肝病毒感染定義為血清B肝表面抗原陽性大於或等於6個月。排除標準:有臨床意義的慢性或急性疾病,使志願者不適合參加本試驗;顯著纖維化或肝硬化;酗酒史或證據;皮下注射不耐受史;除慢性B肝病毒感染外,存在其他原因引起的慢性肝病史;肝失代償史。
關於VIR-2218,目前國內試點醫院:首都醫科大學附屬北京友誼醫院。II期臨床研究面向成人慢性B肝患者,主要評估VIR-2218在我國慢性B肝受試者中的安全性、耐受性、藥代動力學以及抗病毒活性。II期已於2020年8月開始進行,按照全球臨床試驗數據庫登記介紹,本試驗將於2022年6月份完成對外公布數據結論。

小番健康結語:藥物機制方面,VIR-2218是一種基於RNA干擾療法藥物,主要通過抑製全病毒蛋白的表達水準,包含B肝表面抗原的表達水準。伴隨著B肝病毒蛋白水準下降後,可能有助於恢復慢性B肝患者自身針對B肝病毒感染的免疫應答,進而有可能對慢性B肝病毒攜帶者實現功能性治愈(來自騰盛博藥對該藥原文點評)。目前,VIR-2218在我國已進入第2期,一種RNAi療法B肝創新藥。返回搜狐,查看更多
責任編輯: