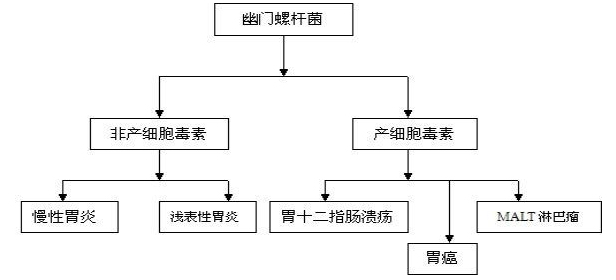
幽門螺桿菌(Hp)是慢性活動性胃炎、消化性潰瘍、胃黏膜相關淋巴組織淋巴瘤和胃癌的主要原因。消化不良、原因不明的貧血和特發性血小板減少性紫癜也與之密切相關。2015年京都共識一致認為,Hp感染相關胃炎是一種傳染病,檢測陽性的患者應接受根除治療。目前,沒有任何治療方案可以保證100%Hp根除率。Hp根除率與許多因素相關,包括治療方案、患者對不良反應的耐受性、患者依從性、患者遺傳多態性、吸煙、糖尿病和其他因素。其中,Hp的抗生素耐藥性是Hp根除治療失敗的主要原因。而隨著全球抗生素耐葯率的上升,Hp的根除率持續下降。在這樣的情勢下,微生態輔助治療可能成為一個新思路。
人體皮膚、消化道及呼吸道中含有大量的定植微生物,這些微生物在調節人體免疫功能、抵抗病原體定植方面起著重要作用。胃部環境雖然苛刻,但除Hp外,胃內仍存在非Hp微生物群落,如鏈球菌和葡萄球菌,稱為胃微生態群。Hp感染可影響胃微生物群的平衡,報告顯示Hp陰性受試者相比Hp陽性受試者的胃微生態群的多樣性更高。
Hp的黏附和毒力因子是致病的主要原因。Hp在胃內定植影響胃部原始細菌的分布和數量,並擾亂微生態平衡,導致疾病。例如,與未感染Hp者相比,Hp感染者胃中的乳桿菌較少。Hp導致微生態失衡主要是因為其產生了抗菌肽cecropin。這種肽可以使其他細菌「自體自溶」。由於缺乏這些細菌的競爭,Hp可以不受控制地進行繁殖,其產生的一系列毒力因子刺激胃上皮細胞,導致細胞凋亡和炎症。因此,增加抗生素的劑量或延長抗生素的使用期可能不僅不會提高Hp根除率,還會導致抗生素耐藥性增加。
微生態治療為Hp根除帶來了新思路。重塑胃中的微生態平衡可以減少Hp定植。中國的一項研究表明,正常小鼠接受Hp懸浮液7天,由此產生的Hp感染率為30%;如果小鼠首先用慶大黴素和阿奇黴素的混合物餵養3天以消除胃內原始微生物群,則7天施用Hp可產生100%的Hp感染率;通過餵食乳桿菌和雙歧桿菌懸浮液7天重建胃微生物群平衡後,Hp感染率降低至30%,Hp定植顯著降低。研究結果支持了以下推測:免疫系統和正常的胃微生物群可以有效拮抗Hp的定植,而胃微生物群平衡的破壞增加了對Hp的易感性。該數據為臨床使用益生菌提高Hp根除率提供了理論依據。
1
益生菌在Hp根除中的循證依據
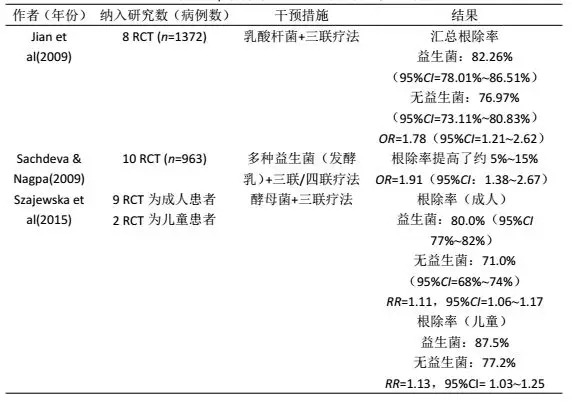
許多薈萃分析和臨床試驗證實,補充益生菌可以提高Hp的根除率,減少根除期間的不良反應。從文獻分析可以得出結論,並非所有益生菌都對Hp具有抑製作用,並且不同的益生菌具有特定的作用。益生菌混合菌株對Hp的抑製作用大於單一菌株。單獨使用益生菌不能完全消除Hp,但可以減少胃中Hp載量,降低尿素呼氣試驗(UBT)的delta值,以及減輕胃黏膜炎症(部分結果見表1)。
一些臨床試驗證明,儘管未完全根除Hp,但益生菌可降低UBT的超基準值(delta-over-baseline,DOB)。DOB值是否能夠定量反映胃內Hp密度仍是一個有爭議的問題。DOB值受許多因素影響,例如Hp定植密度、脲酶活性和胃排空。不同的益生菌可以通過抑製脲酶活性或降低Hp與胃黏膜的附著來降低DOB值,從而降低Hp密度。
表1 益生菌對Hp根除率影響的薈萃分析一覽
(部分)
1
益生菌的作用機制
01
產生抑製或殺死Hp的物質
益生菌可產生多種抑製Hp生長的物質並誘導宿主分泌抗體。抗菌化合物包括細菌素、乳酸、乙酸和過氧化氫(H2O2)等。不同的益生菌菌株會產生不同的抗菌物質。乳酸鏈球菌可以產生乳鏈菌肽,這種帶正電荷的分子可以通過靜電和疏水相互作用與細胞膜結合,然後形成可導致細胞自溶和死亡的通道。枯草芽孢桿菌會產生具有抗菌作用的amicoumacin A和異香豆素類似物,抑製Hp的生長和活性。
Hp感染特徵之一是脲酶的分泌,脲酶可分解胃中的尿素從而產生氨來中和胃酸以保護細菌免受胃酸損害。大多數乳酸桿菌可產生乳酸以抑製脲酶的活性,並且乳酸對Hp有害。Fujimura等人將Hp標準菌株和加氏乳桿菌OLL2716在瓊脂上共培養24小時,電子顯微鏡檢查顯示Hp呈球形,且已經失去生長能力。Hp的另一個特徵是過氧化氫酶活性。益生菌可以產生H2O2,過氧化氫酶作用導致產生許多氧自由基,這些氧自由基可通過對Hp酶活性的干擾而產生抗菌作用。
02
對胃部Hp定植的作用
Hp在胃上皮中的定植是致病的先決條件。Hp一端具有多個鞭毛,其為細菌提供穿透黏液厚層的機械力並定植於胃上皮細胞的表面而不是通過胃的蠕動排泄出體外。定植胃黏膜的能力是篩選可用於拮抗Hp黏附和定植的益生菌的第一步。益生菌可與Hp競爭胃上皮細胞的黏附位點,以減少胃中Hp的定植。Mukai等人發現羅伊氏乳桿菌通過分泌唾液酸神經節苷脂和硫醇鹽來影響Hp的定植,唾液酸神經節苷脂和硫醇鹽可抑製Hp與胃上皮細胞的糖脂連接,以及與Hp競爭唾液酸-神經節-N-四糖基神經醯胺和硫苷脂的黏附位點。體外實驗證實,乳桿菌可以下調Hp黏附素sabA的表達,降低Hp與胃黏膜的黏附。其他研究證明,乳酸桿菌和Hp在胃中的生長是相互拮抗的。如果胃中存在乳酸桿菌,Hp數量將減少。
Hp感染不一定會致病,這與Hp的毒力和數量有關。當胃竇的Hp密度<105CFU/g時,就不會發展為消化性潰瘍。上述觀點認為,雖然口服益生菌可能不能完全根除Hp,但可以減少Hp的黏附及胃黏膜炎症。對於沒有消化系統癥狀的兒童和老年人,口服益生菌減少Hp定植效果優於傳統治療。
03
Hp感染後炎症的抑製作用
Hp感染會導致胃黏膜炎症,通過「慢性胃炎-萎縮性胃炎-腸化生-異型增生-胃癌」這一最常見的演進模式致癌。脲
酶、細胞毒素相關基因A(CagA)、空泡細胞毒素A(VacA)和中性粒細胞蛋白(NAP)是Hp的常見毒力因子。其中,NAP可激活中性粒細胞,還可促進中性粒細胞中活性氧的產生,並介導胃上皮細胞與中性粒細胞的黏附,導致Hp感染後胃炎症級聯反應的激活。白細胞介素-(IL-)8是最早發現的與Hp胃炎相關的細胞因子。它是一種趨化性化合物,可以激活中性粒細胞,誘導胃黏膜細胞變性甚至壞死,還可以刺激黏膜單核細胞和樹突細胞產生腫瘤壞死因子、IL-1和IL-6。樹突細胞活動產生炎症級聯反應。這些反應不足以清除Hp感染,卻會導致慢性炎症。近年來,毒力和炎症因子被用於製備Hp相關疫苗。動物研究表明,基於NAP的口服疫苗有相當高的(80%)有效性。
益生菌調節黏膜免疫反應的機制尚不清楚。但據報導,糞腸球菌、長雙歧桿菌和嗜酸乳桿菌的益生菌混合物可以耐受胃中的酸性環境並存活8小時。這三種益生菌不能減少胃中Hp的定植,但可以減少炎症因子的釋放,如腫瘤壞死因子-α、IL-1β、IL-10、IL-6、粒細胞集落刺激因子,並可以降低巨噬細胞炎症反應。
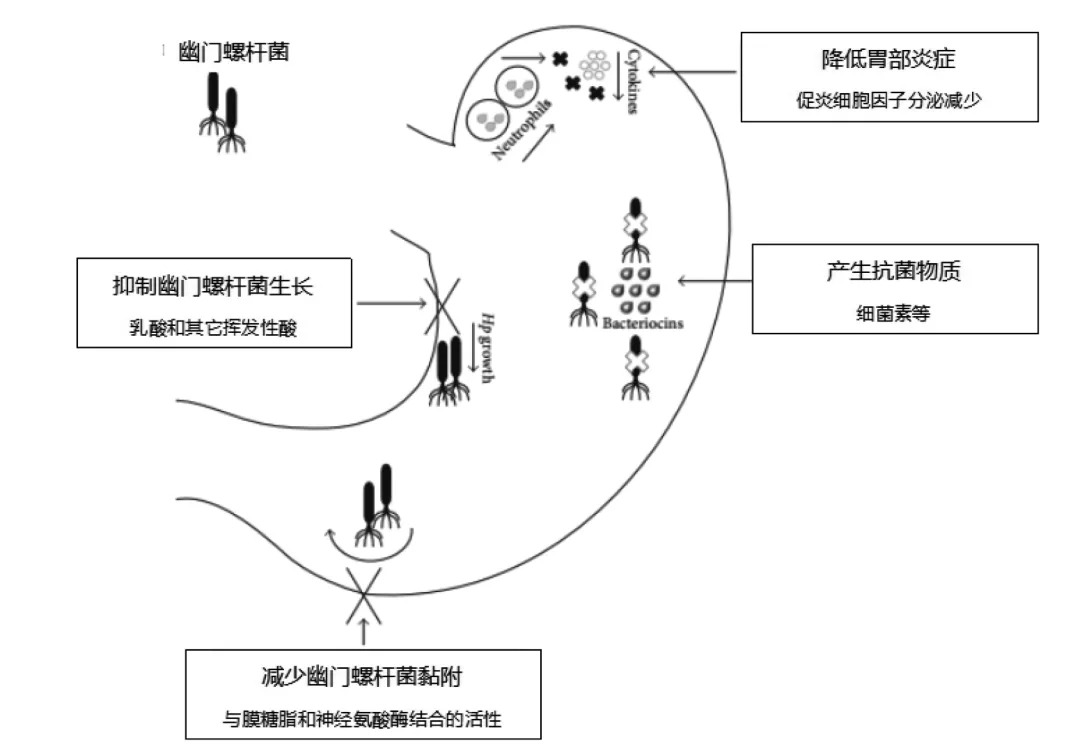
圖1 益生菌的作用機制
(圖片來源:Bruno G, et al. Can J Infect Dis Med Microbiol. 2018 Sep 10;2018:6237239.)
結論
隨著對腸道菌群研究的深入,微生態治療越來越受到人們的關注。益生菌可以幫助提高Hp的根除率並減少不良反應。然而,只有一些特定的益生菌菌株具有這種效果。目前,微生態治療的應用仍需面對如下挑戰:首先,人類的腸道微生物區系受到各種因素的影響,如環境、飲食、遺傳和生活方式,很難直接研究益生菌對人體的影響;其次,由於細菌之間的協同或拮抗作用,難以概括某些益生菌菌株在不同益生菌組合中的作用;第三,由於菌株的特異性和研究結果不一致,目前的結果可能會受到質疑。更多的答案仍需等待未來的基礎研究和臨床研究。