第71屆美國肝病研究學會年會(AASLD2020)虛擬會議將於2020年11月13-16日舉行,美肝會也是全球最大、最權威的肝病學會議,每年均有來自全球各地的9000餘位肝病學專家和從事肝病研究的專業人士前來參加,共同分享肝病學領域突破性成果以及最新治療進展。

B肝在研新藥ABI-H0731,II期211研究,安全性數據
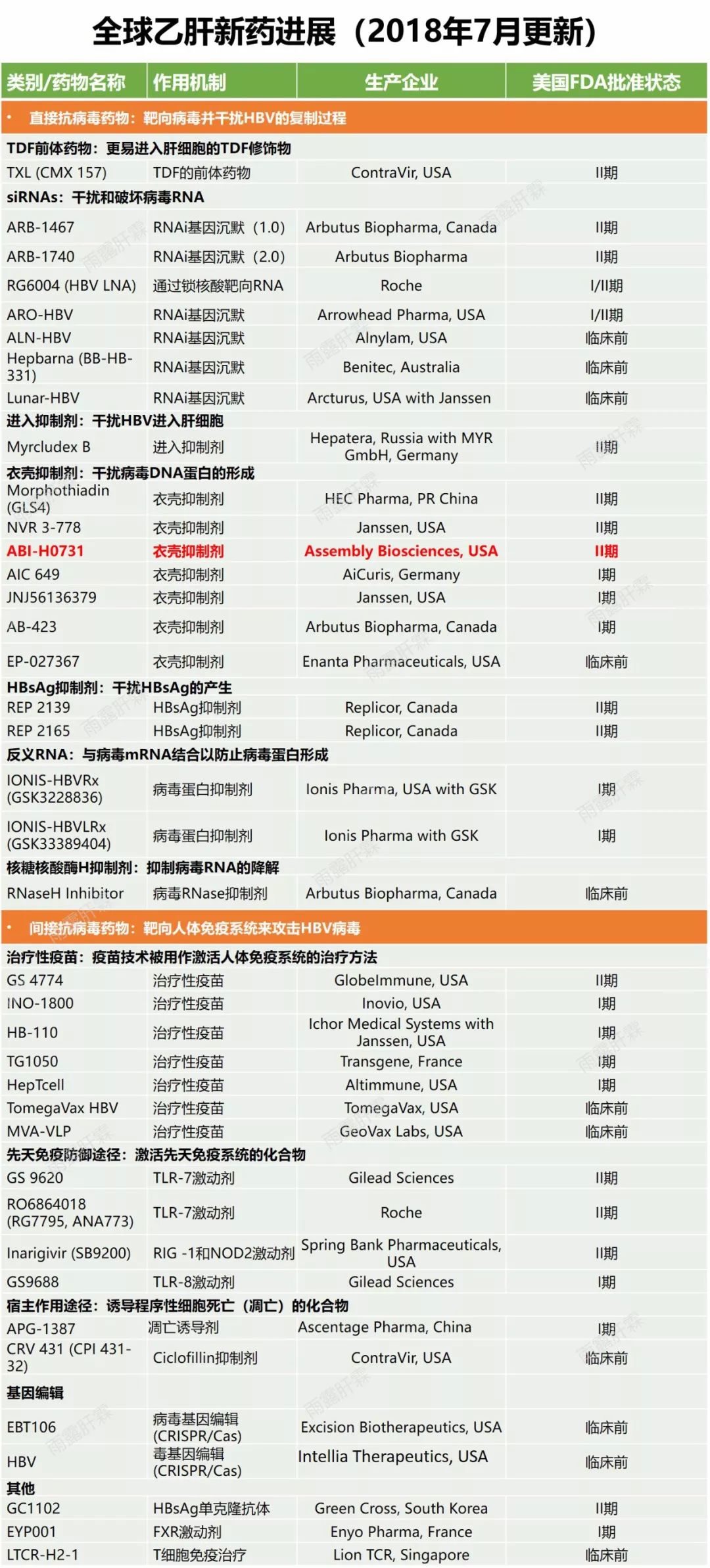
本屆虛擬數字會議上,Assembly Biosciences公司開發的B肝在研新藥ABI-H0731(731)迎來新進展。該研究藥物已經獲得美國FDA授予的快速通道資格,是一種基於核衣殼抑製劑方向的在研B肝新藥。前期已經公布該藥IIa期部分試驗數據,在201研究中,ABI-H0731+恩替卡韋對比單用恩替卡韋的治療方法時,24周給藥後,兩種方案的HBV-DNA未能檢測到比例是69%和0%(p <0.001)(臨床試驗編號:NCT03576066)。
作用原理介紹,在B肝病毒複製過程中,有一個關鍵步驟即衣殼裝配,病毒複製模板cccDNA需和病毒逆轉錄酶共同被包裹入衣殼蛋白中,才能夠完成裝配並促成後續的逆轉錄過程。所以,基於這項靶標開發的衣殼抑製劑,主要通過阻斷衣殼蛋白裝配或加速其降解,都可以影響HBV的複製(作用原理與恩替卡韋、替諾福韋酯完全不同)。

AASLD2020上,Assembly公司研究人員介紹,ABI-H0731屬於1代HBV核心抑製劑。在最新的II期202研究和201研究中,參與者為慢性B肝患者,隨機分配接受ABI-H0731聯用核苷酸逆轉錄酶抑製劑(NrtI)或接受安慰劑,治療為期24周(臨床試驗編號:NCT03577171)。在上述研究完成時,將符合條件的受試者再進入到開放標簽的擴展研究中,指的是211研究(臨床試驗編號:NCT03780543);
211研究參與者接受在研B肝新藥ABI-H0731+核苷酸逆轉錄酶抑製劑,最長100周給藥。參與人數方向,201、202以及211研究,共有95名受試者接受了ABI-H0731聯合核苷酸逆轉錄酶抑製劑;201或202研究,共有40名受試者接受了安慰劑聯合核苷酸逆轉錄酶抑製劑,治療24周。結果表明,基線時受試者平均年齡為43(12)歲,男性佔56%,亞洲人佔87%,平均ALT為34(38)U/L;

以往未經過任何治療的慢性B肝患者佔26%,曾經接受富馬酸替諾福韋二吡呋酯(TDF)治療佔42%,曾接受富馬酸替諾福韋艾拉酚胺(TAF)治療佔22%,曾接受恩替卡韋治療佔10%。ABI-H0731聯用核苷酸逆轉錄酶抑製劑方案,平均(SD)持續時間是65(17)周;安慰劑聯用核苷逆轉錄酶抑製劑方案,平均(SD)持續時間是24(4)周。
II期多數不良事件屬於1級或2級,在對比ABI-H0731+核苷酸逆轉錄酶抑製劑和安慰劑+核苷酸逆轉錄酶抑製劑時,前期治療24周時,兩種治療方案所呈現的不良事件相近。僅有1名發生與研究藥物無關的3級不良事件而導致給藥終止,未發生4級不良事件。最常見不良反應是,報告中,ABI-H0731+核苷酸逆轉錄酶抑製劑方案有發生11次皮疹,且均是1級不良事件(10名,其中1名在給藥27周時終止研究藥物)或2級;
最初發生皮疹的中位時間是4(1-61)周,持續時間是3(0.3-17)周,不良事件多屬於1級或2級。值得注意的是,ABI-H0731+核苷酸逆轉錄酶抑製劑聯合治療期間,關注到不只1名受試者出現ALT與AST升高的3級異常,共關注到3名(佔總受試3%比例)發生一過性或孤立的上述實驗室異常,且未觀察到直接膽紅素或B肝病毒抗原的變化。

小番健康結語:上述研究數據發表在2020年美國肝病研究學會年會(AASLD2020)虛擬會議,是Assembly Biosciences公司開發的B肝在研新藥最新的201、202以及211研究(II期)。總體上,研究人員在對比ABI-H0731+核苷酸逆轉錄酶抑製劑與安慰劑+核苷酸逆轉錄酶抑製劑時,ABI-H0731符合慢性B肝患者給藥後的安全性與耐受性,且已接受這種方案的慢性B肝患者,已經治療長達1至1.5年。
研究發現,伴隨著治療周期延長,較少的不良事件和實驗室異常被研究人員發現。綜合安全性和耐受性的II期試驗數據,支持該研究藥物繼續研發。返回搜狐,查看更多
責任編輯: