通知:成功報名參加2019第二屆腫瘤免疫治療技術研討會的用戶,在大會現場可獲贈由醫麥客傳媒旗下星耀研究院出品的《CAR-T細胞治療產業研究報告-2019V1.1版》一本。限量500冊!!!
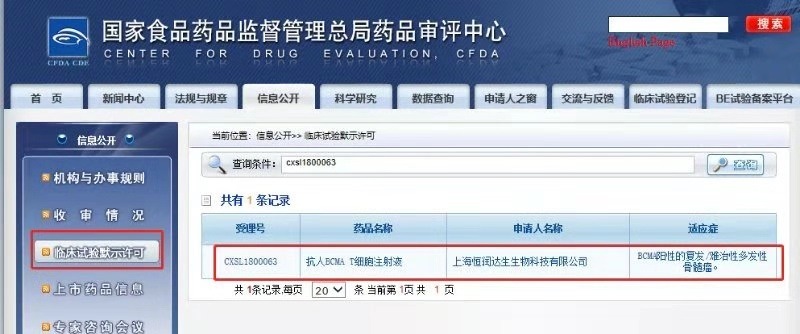
2019年3月15日/醫麥客 eMedClub/--CT053是科濟生物(CARsgen Therapeutics)的主要CAR-T細胞療法之一,在中國國家藥品監督管理局(NMPA)批準其研究性新葯(IND)申請後,該療法很快在中國開始臨床試驗,用於治療複發或難治性多發性骨髓瘤患者。
科濟生物的CT053是一種經過基因修飾的T細胞,能夠特異性地識別和消除多發性骨髓瘤患者體內含有B細胞成熟抗原(BCMA)的惡性腫瘤細胞,同時不損害健康細胞。
在2018年12月舉行的美國血液學會(American Society of Hematology, ASH)會議上,薑松福博士提供了接受CT053 BCMA-CAR-T細胞治療複發或難治性多發性骨髓瘤患者令人鼓舞的安全性和有效性數據。這些患者此前至少經歷過兩次治療無效,之後患者接受了5000萬到1.8億個經過修飾的CT053細胞。


江松福教授ASH年會發言(圖片來源:科濟生物)
數據截止時間為2018年7月10日,本研究共納入16例患者。在所有研究參與者中均未發現與CT053相關的神經毒性或劑量限制毒性。
在研究過程中,只有三名患者出現了細胞因子釋放綜合征,這些問題在阿克替拉(托西珠單抗)治療後迅速得到解決。
在最初登記的16名患者中,有13名符合早期臨床反應的條件,其中12名患者在接受單一劑量的改良CT053 T細胞後,在一個月內獲得快速反應,包括4個部分反應、6個非常好的部分反應和2個完全反應。
在接受治療後的8周內,12名接受了1.5億個或更多CT053細胞治療的患者中,有5人達到了完全緩解。此外,從截止日期的四周開始,13名患者中有12名持續對治療有反應,其中11名患者在治療4至6個月後仍含有活的CT053細胞。
這項早期臨床研究的數據顯示,CT053 CAR-T細胞具有可靠的安全性和有效性。主要的不良事件(副反應)是暫時的、可控的、可逆的。
據《美國醫學會腫瘤雜誌》報導,2016年約有13萬骨髓瘤病例,這意味著從1990年到2016年,全球骨髓瘤發病病例增加了126%,儘管有了新的治療方法,多發性骨髓瘤仍然無法治癒,需要新的治療方案。
該公司計劃在2019年向美國FDA提交BCMA-CAR-T細胞的IND申請。


公司其他管線的CAR-T臨床試驗
該公司的下一代CAR-T特點


關於CARsgen Therapeutics
CARsgen Therapeutics是一家臨床階段腫瘤免疫公司,致力於開發一流的CAR-T療法。CARsgen成立於2014年,總部位於上海,在中國和美國均有業務。CARsgen已經建立了廣泛的CAR-T候選產品系列,涵蓋了未滿足醫療需求的幾個實體瘤和血液腫瘤。該公司已推出多項一流的CAR-T臨床試驗,用於治療複發/難治性腫瘤,包括用於肝細胞癌(HCC)和鱗狀肺癌的CAR-GPC3-T試驗,CAR-EGFR/EGFRvIII-T試驗用於胃和胰腺癌的膠質母細胞瘤和CAR-Claudin18.2-T試驗。CARsgen還正在進行臨床計劃,其中包括針對白血病的人源化CAR-CD19-T試驗,以及針對多發性骨髓瘤的完全人CAR-BCMA-T試驗。
參考來源:
公司官網
點擊下方,搶先報名參與大會!