編者按:醫學工作者需要寫醫學論文,大都需要進行醫學科學臨床研究設計。醫學研究設計不僅是對科研的探索,而且有助於我們順利完成課題的探索。那麼醫學工作者如何進行臨床研究設計呢?「第一屆國際肝臟研究學會年會(IASL 2019)」期間,國家消化系統疾病臨床醫學研究中心方法學平台、首都醫科大學附屬北京友誼醫院孔媛媛從實踐角度進行了回答。小編特整理報告精華,以饗讀者。
臨床研究的問題與設計類型
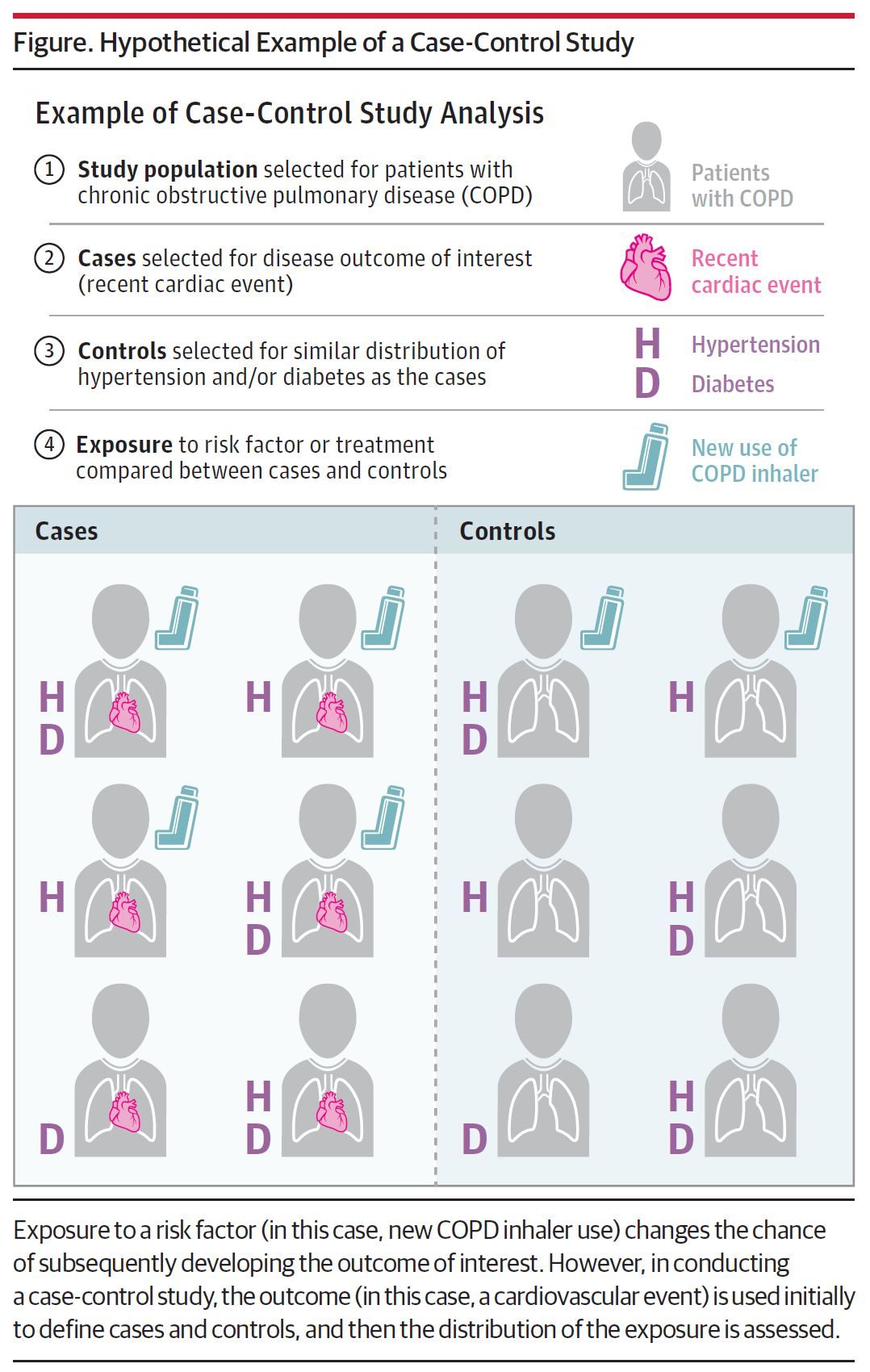
首先,我們需要了解臨床研究分類。通常來說,臨床研究問題的類型包括:①病因與危險因素研究;②診斷試驗評價;③預防與治療效果評價;④預後及預後因素研究。臨床研究設計類型包括:試驗性研究和觀察性研究。試驗性研究屬於乾預性研究,是指人為、外加的乾預,使得隨機分組成為可能,形成對比、控制混雜,包括:隨機對照試驗、交叉試驗和前後對照試驗。而觀察性研究是指非人為控制試驗條件,自然形成分組,儘可能控制混雜因素對結果的影響,包括:隊列研究、病例-對照研究和橫斷面研究。
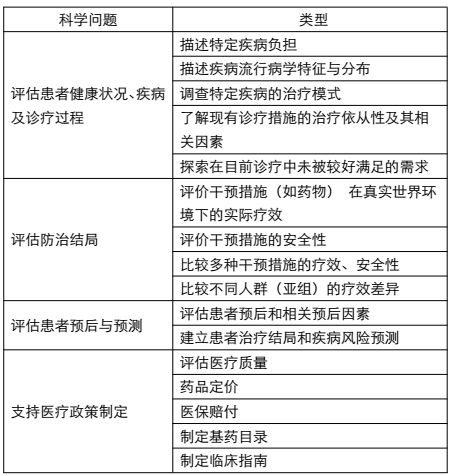
研究設計是決定證據質量的最主要因素。在根據乾預效果評價的臨床證據分級中,系統評價和薈萃分析、隨機對照雙盲研究、隊列研究的臨床證據等級相對較高。那麼,針對不同的醫學問題,採用何種研究設計更為合適?詳見下方表格:
表1 常見醫學問題的最佳研究設計


真實世界證據
此外,近年來真實世界證據(Real-World Evidence)成為了臨床研究者和統計專家討論的熱點,我們如何把「真實世界」數據應用到自己的研究中呢?2016年12月頒布的《21世紀治療法案》中將RWE定義為:除隨機對照試驗以外的其他來源獲取的關於醫療產品使用、獲益及風險相關的數據。
Real World有兩個考量維度:數據獲得和研究方法。真實世界研究的數據可以來源於現實醫療環境(隨機對照試驗),可以採用觀察性研究的設計(如隊列研究、病例-對照研究和橫斷面研究)。隨機對照研究與註冊研究結合是真實世界研究的一種新設計模式。
但是,需要提醒大家的是,真實世界數據(RWD)≠真實世界證據(RWE)。2018年12月頒布的《真實世界證據方案框架》進一步詮釋了RWD和 RWE 的定義:RWD是指通過多種途徑收集的與患者健康狀況或者醫療行為相關的數據,RWE是指通過分析RWD產生的與醫療產品的使用、潛在獲益及風險相關的臨床研究證據。RWD的數據標準的要求是相關性和有效性,RWE質量評價包括數據質量、研究設計和實施情況。
資料庫建立思路
臨床研究建立在資料庫基礎上,資料庫的建立需要考慮八個關鍵要素:①注重註冊登記;②兼顧全面與時效的平衡性,關鍵變數優先收集;③變數維度包括PICOST因素(患者、乾預、對照、結局、研究類型和時間窗);④變數類型包括基線變數、隨訪變數和結局變數;⑤數據要嚴格定義;⑥考慮中國人群的獨特特徵;⑦注意生物標本的收集;⑧倫理問題。
此外,需要對基於電子數據採集(EDC)系統的數據進行質控與核查:①進行欄位編碼,即定義名稱、長度、合理值範圍等;②設置必須填項,即設置為填寫後才能保存提交;③進行實時的邏輯核查,即基於編碼表的合理值範圍,發起錄入的實時提示。當然,EDC系統有替代方案——Epidata,其優點是免費、雙錄入(可保證數據質量)、欄位控制(保證準確性)、適用於多中心錄入,但也有局限性,如質疑管理、修改留痕和許可權設置。
小結
總之,研究設計是決定證據質量的最主要因素,真實世界研究要注意混雜因素的控制。沒有最完美的研究設計,只有最適合的研究設計。真實證據=真實可靠的數據+嚴謹的研究設計+正確的統計分析。要爭取最完美,不放棄最適合,多學科的精誠合作是關鍵。

 播放GIF
播放GIF
TAG: |