這是一項給業內人士了解試驗設計的完整內容,B肝、C肝等病毒性肝炎是最常見的進展到肝細胞癌的主要原因,香港中文大學和CCTU公司研究人員共同發起的一項治療肝細胞癌潛在藥物Pembrolizumab的II期試驗(見下圖)。

B肝HCC新藥II期,3周輸注200毫克,觀察2年響應率
這項試驗來自全球臨床試驗數據庫登記信息,臨床試驗編號:NCT03419481,2019年12月6日更新一次試驗進展。它是一項單臂試驗,對B肝病毒相關肝細胞癌患者進行基線和連續免疫環境變化的平行研究。受試者都具有肝癌(HCC)確診,確診方法按照AASLD指南,並通過B肝表明抗原陽性來確定慢性B肝病毒感染。
至少持續12周進行抗病毒,並在第一次服用研究藥物Pembrolizumab之前,B肝病毒載量必須小於100 IU/mL。此外,他們還必須患有不能接受治療或局部消融術的疾病。受試者必須與基線檢查和治療後腫瘤活檢相符。在實體瘤(RECIST)1.1中,受試者必須至少有一個符合反應評估標準的可測量病變,東方腫瘤合作組(ECOG)的績效評分為0或1,並且具有足夠的器官功能。
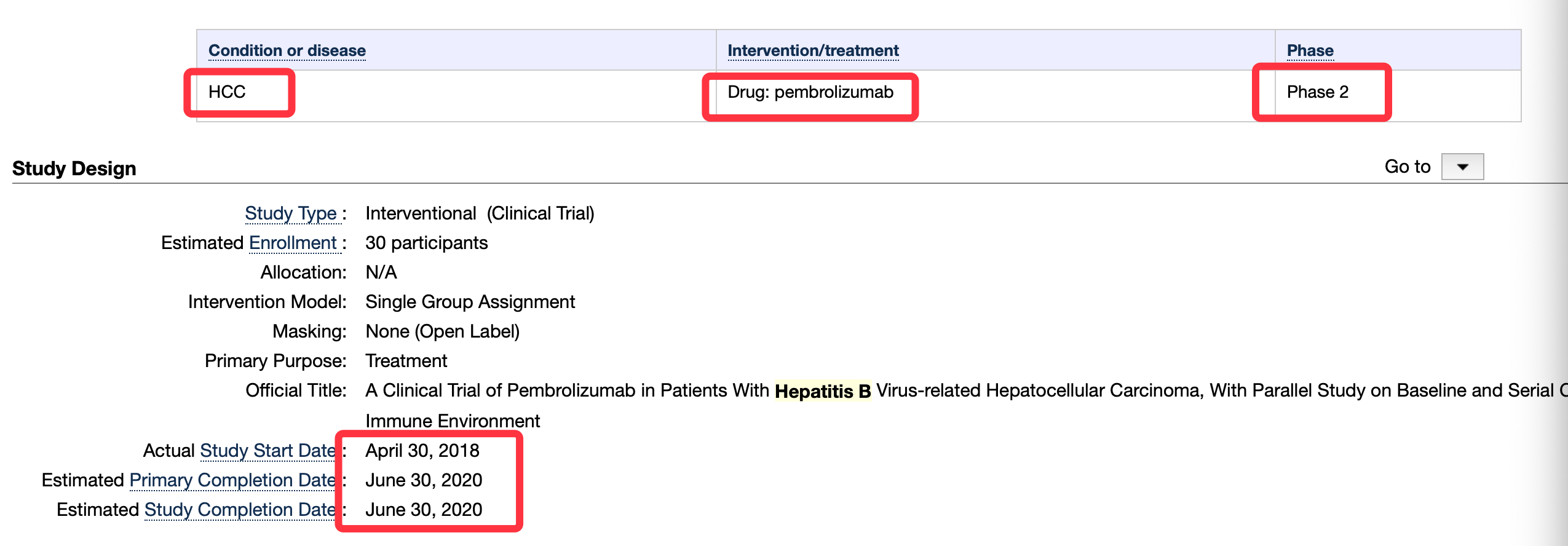
招募30名受試者,將按照每3周(第三周)靜脈注射200毫克Pembrolizumab(單抗)。在兩個周期的Pembrolizumab治療前和治療中進行活檢。當疾病進展或出現無法忍受的毒性時,將終止治療。研究主要目的是,研究Pembrolizumab治療B肝相關肝癌的安全性和有效性,並研究治療後活檢中的免疫相關基因組RNA表達變化。
本研究次要目標是,研究治療前後樣本之間細胞因子譜的系列變化,研究PD-L1免疫組化(IHC)在腫瘤組織中的表達,並研究基線和治療後腫瘤組織中是否存在腫瘤浸潤淋巴細胞。本研究探索性目的是,評估使用免疫相關基因面板或PD-L1/2ihc的基線和RNA表達的序列變化,來預測治療反應的可能性。Pembrolizumab,即默沙東PD-1單抗Keytruda,研究於2020年6月30日完成。

實驗組:Pembrolizumab,按照每3周輸注200毫克,主要結果指標:2年治療期間,響應率(RR)根據RECIST1.1。次要結果指標:2年期間的1年生存率、評估反應持續時間、無進展生存期、進展時間以及總生存期。研究需符合年齡18歲以上成人或老年人,確診為晚期肝細胞癌,根據AASLD指南;以B肝表明抗原陽性,定義慢性B肝病毒感染;
對e抗原陽性慢性B肝,必須給予至少12周的抗病毒治療,並在第一次服用Pembrolizumab之前,HBV-DNA必須小於100 IU/mL。研究期間,病毒載量低於100 IU/mL的受試者,應保持相同的方法。符合基線與治療後腫瘤受試者納入標準者才有資格參與到本項研究,受試者必須:願意並能夠為試驗提供書面知情同意書/同意書。簽署知情同意書當日年滿18歲。根據RECIST 1.1有可測量的疾病。願意提供從新獲得的核心組織或腫瘤病變的切除活檢組織等。

排除標準:目前正在參與並接受研究治療,或已參與研究藥物的研究並接受研究治療。在研究第1天之前的4周內有抗腫瘤單克隆抗體(mAb),或由於4周前服用藥物而導致的不良事件未恢復(即≤1級或基線水準)。在研究第1天之前2周內曾接受過化療、靶向小分子治療或放射治療,或因先前服用藥物而未從不良事件中恢復(即≤1級或基線水準)等。

小番健康結語:這是一項登記在冊的治療肝細胞癌在研新藥Pembrolizumab的II期單臂試驗。通過介紹試驗設計、試驗方法以及參照結果指標,有助於行業內人士相互交流心得,科學認識一些領域潛在創新藥物的開發進度,同時,也為廣大讀者帶來更多專業知識,了解前沿醫藥技術情報,如本文所提Pembrolizumab,是默沙東PD-1單克隆抗體,在研B肝相關肝癌新藥。返回搜狐,查看更多
責任編輯: