作者:漢鼎好醫友
近日,美國FDA批準輝瑞公司的利妥昔單抗(Rituximab)生物類似物Ruxience(rituximab-pvvr)上市,用於治療包括非霍奇金淋巴瘤在內的多種成人血液腫瘤和自體免疫疾病。
此次批準是基於對一項綜合數據集的審查評價了Ruxience的療效、安全性和免疫原性。結果發現,在CD20+低腫瘤負荷濾泡性淋巴瘤患者中,Ruxience在藥物安全性、臨床有效性和藥物質量方面達到了同參考藥物等效的結果。
Ruxience類似於利妥昔單抗,其工作原理是針對一種名為CD20的蛋白,這種蛋白存在於B細胞表面。當它與CD20結合時,利妥昔單抗有助於破壞B細胞。
「利妥昔單抗最初獲得FDA批準時屬於首批單克隆抗體(mAb)抗癌藥。這是一項重大的治療進展,也是腫瘤醫生及其患者在相當長一段時間內的唯一選擇。」美國腫瘤血液學研究中心Jeff Sharman博士說。「隨著一個個生物類似葯的獲批,臨床醫生和患者有了額外的治療選擇,這將有助於改善這類患者的醫療負擔。」
Ruxience(rituximab-pvvr)獲批的適應症有:
◆非霍奇金淋巴瘤(NHL)
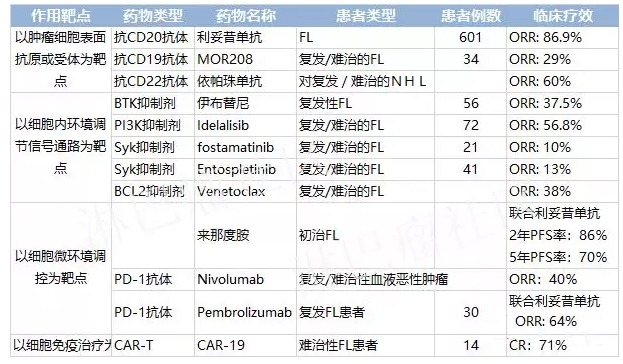
1.單葯治療複發或難治性,低級別或濾泡性,CD20陽性B細胞NHL
2.聯合一線化療用於以前未經治療的濾泡,CD20陽性B細胞NHL
3.一線CVP化療(環磷醯胺+長春新鹼+強的松)後單葯治療非進展性(包括病情穩定)、低級別、CD20陽性B細胞NHL
4.聯合CHOP化療(環磷醯胺+阿黴素+長春新鹼+強的松)或其他基於蒽環類藥物的化療方案用於以前未經治療的瀰漫性大B細胞,CD20陽性NHL
◆慢性淋巴細胞白血病(CLL)
聯合氟達拉濱和環磷醯胺(FC),用於CD20陽性CLL成年患者
◆成人肉芽腫伴多血管炎(GPA)(韋格納肉芽腫)
◆顯微鏡下多血管炎(MPA)合併糖皮質激素
利妥昔單抗的生物類似葯
上市20年來,利妥昔單抗(美羅華)持續保持穩定增長,近10年的複合增長率超過5%,2017年全球銷售額更是超過了70億美元。
2000年4月21日,羅氏利妥昔單抗獲國家葯監局批準在國內上市,適應症為CD20陽性的濾泡型和瀰漫大B細胞型非霍奇金淋巴瘤。
2017年,利妥昔單抗通過國家醫保談判進入醫保目錄,價格砍去一半,500mg/50ml/瓶的規格從16041元降到8298元,100mg/10ml/瓶小規格也降到2418元。然而,由於醫保報銷項目的限制,患者整體負擔依然較重。
2018年,FDA已批準了韓國葯企Celltrion Healthcare的生物仿製葯Truxima(rituximab-abbs),用於單葯或與化療聯用治療成人CD20陽性、B細胞非霍奇金淋巴瘤(NHL)。這是第一個在美國獲批的利妥昔單抗生物類似葯。
今年,由復宏漢霖研製的中國首個利妥昔單抗生物類似葯(漢利康)獲批上市。此外,近日,國家葯監局也已受理信達生物利妥昔單抗生物類似葯IBI301的新葯上市申請。相信在不遠的將來,利妥昔單抗的價格將越來越親民,真正為國內患者「減負」。
什麼是生物類似葯?可以替代原研葯嗎?
過去10年,生物類似葯一直是醫療行業變革的一個重要催化劑,有助於建立更可持續的醫療體系。
生物類似葯是指在質量、安全性和有效性方面與原研葯(參照葯)有相似性的治療用生物製品,其氨基酸序列原則上應與原研葯相同。
不同於常見的小分子葯,生物製劑通常具有高分子複雜性,且對生產過程的變化非常敏感,但現有技術尚不能充分表徵生物葯的結構和其他特性。同時,藥品生產過程中的細微差異可能對最終產品的質量、純度、生物學特性及臨床效果產生很大影響。這些因素決定了生物類似葯不可能與原研葯完全一樣。
在美國 ,對於小分子化學仿製葯,藥劑師可不經處方醫生允許,直接將處方中的原研葯替換為仿製葯,降低藥品費用。但FDA對生物類似葯則更加謹慎,生物類似葯須在FDA已批準其具可互換性的前提下,才能在不經處方醫生允許的情況進行替換(詳情參見FDA紫皮書,各州法規略有差異)。
參考資料:
本文轉載自其他網站,不代表健康界觀點和立場。如有內容和圖片的著作權異議,請及時聯繫我們(郵箱:[email protected])