幾年前,麻省理工學院(MIT)大腦與認知科學系教授蔡立慧等神經科學家們發現,只要讓患有阿爾茨海默症的小鼠暴露在特定頻率的燈光下,就能顯著減少這種疾病常見的澱粉樣斑塊。最近,這名華人科學家帶領的團隊的一項新發現有助於解釋該現象,在細胞水準上驗證了這種療法的效果。
該成果於5月7日在線發表在《神經元》(Neuron)雜誌。研究人員認為,這種療法不僅有益於神經元,還幫助一種負責清除大腦碎片行使「免疫吞噬」功能的小膠質細胞。總的來說,這種療法可以減少炎症、增強突觸功能、防止細胞死亡。
研究人員還發現,閃爍的光刺激增強了小鼠的認知功能,在空間記憶測試中,小鼠的表現要比未經乾預的小鼠好得多。這種療法還對老年健康小鼠的空間記憶產生了有益的影響。
蔡立慧是對阿爾茨海默症領域的科學研究有接觸貢獻的華人學者,憑藉在該領域的諸多工作,其於2011年當選為美國國家醫學院院士,美國國家醫學院是美國國家學院(United States National Academies)四大機構之一。


麻省理工學院(MIT)大腦與認知科學系教授蔡立慧 MIT官網 圖
有益的腦電波
阿爾茨海默症,俗稱老年癡呆症,是一種發病進程緩慢的神經退行性疾病。1906年,德國精神病學家和病理學家愛羅斯?阿爾茨海默(Alois Alzheimer)首次發現並以他的名字命名了這種疾病。至今100多年過去,人類尚沒有找到解開這道難題的鑰匙。
目前對於該病的致病機理眾說紛紜,主流假說主要集中在β澱粉樣蛋白堆積以及Tau蛋白質過度磷酸化。然而,截至目前,國際各大葯企基於這些假說的藥物研發紛紛折戟。
蔡立慧帶領團隊另闢蹊徑的這種方法,被認為可能打開阿爾茨海默症治療的新格局。
蔡立慧的思路在於,此前的研究發現,阿爾茨海默病患者往往伴隨著γ波振蕩受損癥狀,這也被認為是該疾病的結果之一,蔡立慧團隊正是反以此結果為切入點。
腦波,是指人腦內的神經元細胞之間傳遞信息時產生的生物電信號。人類的大腦在不同行為及狀態下可以產生多種腦波,常用的為β波、α波、θ波、δ波和γ波等。其中γ波的頻率為典型為40赫茲,γ波被認為有助於正常的大腦功能,如注意力和記憶力。
2016年12月,蔡立慧等人最初對閃爍光的影響進行的研究表明,以40赫茲的頻率進行的視覺刺激會在視覺皮層中產生γ波,減少大腦中的β澱粉樣蛋白。
2019年3月,團隊進一步發現,將閃爍的光和聲音刺激(40赫茲)結合起來,可以進一步減少斑塊,併產生顯著的影響,延伸到與學習和記憶相關的海馬和部分前額皮質。研究人員還發現,這種非侵入性的光和聲誘導的γ波對認知都有好處。
在研究團隊的這項最新研究中,研究人員想要更深入地研究這些有益影響是如何產生的。他們重點研究了兩種不同的小鼠,均通過基因工程導致小鼠患有阿爾茨海默症。
其中一種被稱為Tau P301S,Tau蛋白產生突變,這種蛋白會形成神經原纖維纏結。這也是阿爾茨海默症患者腦部的明顯特徵之一。另一種被稱為CK-p25,可以誘導產生一種叫做p25的蛋白質,導致嚴重的神經退行性變。
蔡立慧說,這兩種模型顯示的神經元損失都比他們在最初的光閃爍研究中使用的模型要嚴重得多。
研究人員發現,對小鼠進行視覺刺激,每天1小時,持續3到6周,對神經元退化有顯著的影響。研究團隊實施乾預的時間點是在上述兩種類型的阿爾茨海默症小鼠即將出現神經元退化之前。
結果顯示,經過3周治療的Tau P301S小鼠沒有出現神經元變性,而未經治療的Tau P301S小鼠失去了15%-20%的神經元。CK-p25小鼠的神經退行性變也得到了預防,它們則接受了6周的治療。
「我研究p25蛋白已經超過20年了,我知道這是一種非常具有神經毒性的蛋白質。我們發現,p25轉基因表達水準在治療組和未治療組小鼠中完全相同,但在治療組小鼠中沒有發生神經退行性變。」蔡立慧說,「我從來沒看到過這種現象,這很令人震驚。」
研究人員還發現,在莫裡斯水迷宮的空間記憶測試中,接受治療的小鼠表現得更好。有趣的是,他們還發現,這種療法改善了老年小鼠的表現,這些小鼠沒有患阿爾茨海默症的傾向。


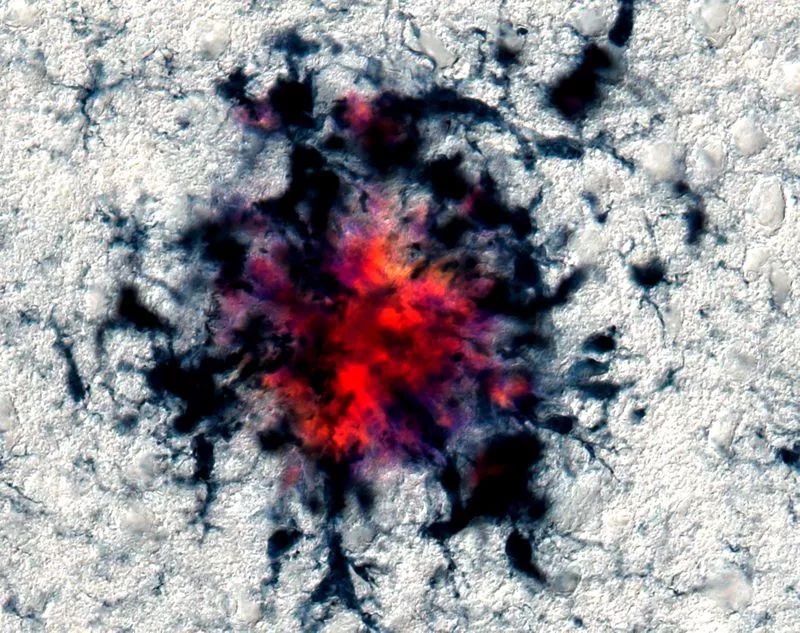
左:阿爾茨海默氏症小鼠大腦;右:接受了非侵入性視覺刺激治療的小鼠,顯示出神經退行性變要少得多。
基因變化
為了弄清楚在細胞水準上發生了什麼,研究人員分析了治療組和未治療組小鼠的基因表達變化,包括神經元和小膠質細胞。
在未治療小鼠的神經元中,研究人員發現與DNA修復、突觸功能和細胞囊泡轉運相關的基因表達下降,而囊泡轉運對突觸的正常功能至關重要。然而,經過治療的小鼠比未治療的小鼠表現出更高的基因表達。研究人員還發現,在接受治療的小鼠身上,突觸的數量更多,一致性也更強(測量大腦不同部分之間的腦電波同步程度)。
在對小膠質細胞的分析中,研究人員發現,未治療小鼠的細胞表達了促進炎症的基因,但經過治療小鼠的這些基因明顯減少,與運動相關的基因增加。研究人員說,這表明在接受治療的小鼠中,小膠質細胞可能在對抗炎症和清除可能導致澱粉樣斑塊和神經纖維纏結形成的分子方面做得更好。他們還發現容易形成纏結的Tau蛋白水準也較低。
蔡立慧說,研究人員目前正在研究的一個關鍵問題是γ波是如何觸發所有這些保護措施的。
「很多人一直在問我,小膠質細胞是否是這種有益作用中最重要的細胞類型,但說實話,我們真的不知道。」蔡立慧說,「畢竟,γ波振蕩是由神經元發起的,我仍然認為它們是主要的調控器。我認為這種振蕩本身一定觸發了一些細胞內的事件,就在神經元內部,而且它們在某種程度上受到了保護。」
研究人員還計劃在癥狀較嚴重的小鼠身上測試這種療法,看看神經退行性變開始後能否逆轉。
值得一提的是,研究團隊還開始了對人類患者進行光和聲音刺激的I期臨床試驗。