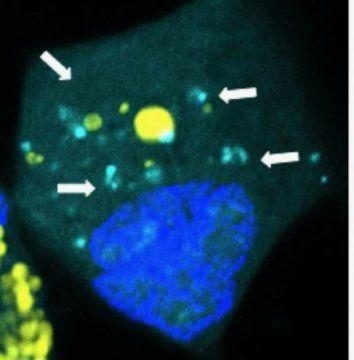

米粒子在人類腦癌細胞釋放微小核糖核酸(miRMA亮藍色)
Credit: YuanRui, Johns Hopkins
約翰·霍普金斯大學醫學院(Johns Hopkins School of Medicine)的科學家們在「概念驗證性」研究中表示,他們已經成功地製造出裝有編碼基因 miRNA 的納米包裹,來治療至植入小鼠體內的人類腦腫瘤。這種超小容器中盛放的物質靶向癌症乾細胞,癌症乾細胞是產生無數後代的癌症細胞「種子」,還是消除大腦惡性細胞的無情障礙物。
該實驗結果在線發表在6月21日的 Nano Letters上。
「就遺傳構成而言,腦癌是最為人所了解的癌症之一。但是我們尚未開發出一款好的治療方案來對付它,」約翰霍普金斯大學醫學院的John Laterra教授說道:「其中的主要障礙就是癌症乾細胞的復原力和血腦屏障。」
血液進入大腦前,要經過一系列血管的過濾,這些血管對大腦起到了保護屏障的作用。然而這種血腦屏障會阻斷靶向癌症乾細胞的藥物分子進入大腦,而這些藥物分子有徹底改變腦癌治療的潛力。Laterra說道。
約翰·霍普金斯大學醫學院的 Jordan Green 表示:「為了讓腦癌治療方法現代化,我們需要繞過血腦屏障的技術和工具,使敏感的基因藥物能被安全有效地直接輸送入腫瘤,而不破壞正常組織。」 「一個典型的例子就是膠質母細胞瘤。」Green 說。它通常需要反覆手術來進行治療,醫生能清除掉他們看得見的腦瘤組織,但可惜的是,惡性腫瘤通常恢復得非常迅速。大多數膠質母細胞瘤患者在確診後存活時間不到兩年。
長期以來,科學家一直懷疑癌症乾細胞是驅動癌症複發和擴散的根源。這些乾細胞會產生其他癌細胞,如果它們躲過了外科醫生的手術刀,就可能導致全新的腫瘤出現。
Laterra 和 Green 設計出一種有效的方法,他們將超小的 miRNA 包裝入已成形的腦瘤中。 miRNA 靶向腦癌乾細胞,阻止它維持腫瘤生長、傳播的能力。 這種包裹採用生物可降解塑料製成,它類似於手術縫合材料,可隨時間降解。它大約是人類頭髮的千分之一大小,具有細胞用來交流的天然成分的典型形狀和大小。當癌細胞吞噬包裹時,包裹分裂並釋放 miRNA 的「有效負載」,尤其靶向需要 miRNA 作用的地方。
納米包裹中的 miRNA 會特異性地結合兩個基因的 RNA 信使基因: HMGA1和 DNMT,這兩個基因共同起作用,調節細胞中的基因表達程式。
當 miRNA 與這些 mRNAs 結合後,可以阻斷它們製造蛋白質的能力,並關閉癌細胞的乾細胞特徵程式。當癌細胞沒有了乾細胞的特點,他們會進一步分化,失去傳播腫瘤的能力,並有可能更容易受到藥物和輻射的影響。
霍普金斯的科學家們將人類膠質母細胞瘤細胞植入18隻小鼠體內。為了模仿臨床治療中的挑戰,科學家們等待了45天后才開始進行治療實驗,這是為了確信腫瘤已經形成良好的形態。
試驗中將納米包裹直接注射入腦瘤中,一半的小鼠接受包含活性miRNA的納米包裹(實驗組),另一半接受非活性的納米包(對照組)。為了研究這些納米包裹的獨立效果,實驗室用的是沒有免疫系統T細胞的小鼠。
對於對照組的9隻小鼠,兩個月內有5隻死亡,剩餘的4只在90天內死亡。實驗組的9隻小鼠中,有3只存活80天,剩餘6只存活長達133天。而133天的這6隻最後被施行了人道安樂死,然後研究人員分離出小鼠的大腦,以確認是否還存在腫瘤。
對照組中所有小鼠死亡時大腦中都存在腫瘤,存活133天的6隻中,死亡時有兩隻大腦中存在小腫瘤,另外四隻腦內沒有腫瘤。
Green 表示,許多基因藥物都隻靶向與單個基因。而霍普金斯小組設計的這種納米顆粒可以封裝多種類型的miRMA,以作用於多個基因網路。
「當腦癌乾細胞吸收納米顆粒並轉化為非乾細胞狀態時,臨床醫生便可趁機進行輻射或藥物治療,來殺死這些脆弱的細胞。」Laterra 說道。
Green說,還有別的研究團隊在用脂質材料開發 miRNA 包裹,一些標準的化療是通過脂質體來進行給葯的。
在 Green 和 Laterra 的試驗中,納米顆粒之所以能滲透整個腫瘤,是因為嚙齒動物的大腦很小。他們表示,人的大腦較大,可能需要泵和導管來彙集大腦中的納米顆粒。
約翰·霍普金斯大學的團隊正在努力擴大納米顆粒的研發,並在申請人體臨床試驗之前,使其穩定性和品質符合標準規定。
該研究小組已就該研究中使用的部分技術申請了專利。
來源:約翰·霍普金斯大學醫學院
翻譯:卓思琪
審校:阿金