近日,採用RNA療法制劑的B肝國產在研新藥STSG-0002注射液完成首例受試者給藥。本期是I期臨床試驗,根據舒泰神昨日公告顯示,I期試驗題目:評價STSG-0002注射液安全性、耐受性及初步有效性的。

B肝國產在研新藥STSG-0002,Ia期部分,完成首例給藥
前期小番健康已有科普該藥最新進展,2019年6月中旬舒泰神(北京)生物製藥與北京三諾佳邑生物共同申請STSG-0002注射液的臨床試驗,並且已於9月中旬獲得國家藥監局(NMPA)批複展開針對慢性B肝治療的臨床試驗。公告顯示,I期臨床試驗在北京大學第一醫院進行,並於近日完成首例受試者給藥。回顧關於STSG-0002注射液臨床前研究:
該創新藥為注射劑,有顯著嗜肝特性,可通過單次靜脈注射,每月完成1次,能夠在慢性B肝患者肝細胞內實現長期表達siRNA。動物試驗時,給予小鼠注射7天后,出現明顯抑製血清HBV-DNA滴度,長期抑製效果直到給藥的第252天,未發生HBV-DNA顯著反彈。因此,STSG-0002臨床前基本證明在B肝動物體內明顯持續抑製DNA病毒作用。

該藥I期試驗專業題目:多中心、開放性、劑量遞增評價STSG-0002注射液對無症狀慢性HBV感染者的安全性、耐受性及初步有效性Ia期臨床試驗。根據昨日舒泰神公告,STSG-0002注射液是我國I類治療用生物製品,2019年6月27日獲得受理,屬於“特殊審批程序”品種。臨床試驗通知書號:CXSL1900065,並於2019年12月通過北京大學第一醫院生物學研究倫理委員會批準,已完成在國家藥監局藥物臨床試驗登記和信息公示平台公示I期臨床信息。
公告介紹到,STSG-0002屬於基因藥物,即小核酸基因藥物,毒性靶向肝髒的我國在研B肝創新藥。藥物作用機制上,STSG-0002和以往核苷酸類似物或干擾素都不相同,核苷類藥物或干擾素無法直接把慢性B肝患者體內的表面抗原水準降下來,因而需要通過長期口服,才能夠阻止慢性肝髒炎症繼續發展為肝硬化或肝癌。但STSG-0002注射液屬於基因藥物,也是目前全球B肝藥物全新靶點。

若將STSG-0002注射液和核苷酸類似物之一恩替卡韋(ETV)進行比較,STSG-0002仍具備一定優勢,主要源於研究人員觀察對照兩者治療時,存在血清B肝表面抗原和e抗原差異性。調降表面抗原與e抗原,是STSG-0002另一個觀察優勢。在臨床前動物體內試驗,給予7天STSG-0002注射液後,B肝表面抗原、e抗原出現明顯下降。14天給藥後,表面抗原與e抗原降至最低檢測值。
在後續隨訪觀察中,研究人員給予中等劑量與高劑量,上述兩項指標均為反彈,保持持續低於最低檢測值。252天給藥後,上述兩項指標依然沒有發生明顯反彈。因而,在臨床前研究中,STSG-0002總體表現出符合進入到人體臨床試驗的標準,也屬於我國藥企研發的B肝創新藥,作用靶點和核苷類藥物、干擾素不相同,實為全新靶點的RNA干擾類藥物。

近日公告的是STSG-0002的Ia期部分臨床試驗,完成首例受試者給藥。該藥適應症:慢性B肝。我國現有已上市的有核苷類藥物(NA),包括拉米夫定(LAM)、替比夫定(LDT)、恩替卡韋(ETV)、阿德福韋酯(ADV)、富馬酸替諾福韋二吡呋酯(TDF)。NA類藥物,可以通過抑製病毒DNA逆轉錄酶活性,進而抑製B肝病毒複製。雖然,現有NA類藥物可以有效降低慢性B肝患者的HBV-DNA病毒載量,部分可以實現低於檢測值水準。
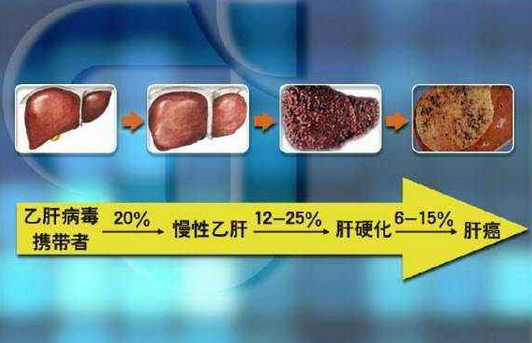
但是,NA類藥物對慢性B肝患者的B肝表面抗原、e抗原的產生沒有直接抑製作用。簡單的講,現有B肝藥物還無法有效降低B肝表面抗原水準,而B肝表面抗原持續存在也是導致肝硬化、肝癌的主要原因之一。干擾素雖然兼具抗病毒和免疫調節作用,能夠有效促進免疫力,但需要依靠注射給藥,慢性B肝患者獲得持續病毒學應答偏低,並且對人體副作用較多,費用較為高昂。

小番健康結語:一種基於RNAi療法的基因藥物,國產B肝在研新藥STSG-0002注射液,完成Ia期臨床試驗首例受試者給藥。試點醫院:北京大學第一醫院,昨日舒泰神公告顯示,I期試點醫院新增加重慶醫科大學附屬第二醫院、通化市中心醫院。(以上臨床試驗進展來自舒泰神昨日公告內容)返回搜狐,查看更多
責任編輯: