衣殼組裝調節劑(CAM),已經成為全球慢性B肝開發重要方向之一,作為新型抗病毒劑開發已產生許多化合物進入到臨床研究。
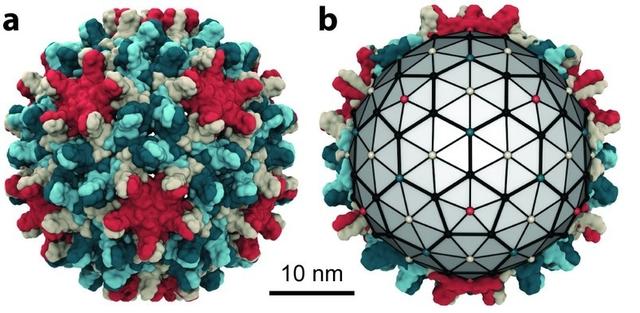
來自JCM,圖 1. HBV 核心蛋白 N 端結構域 3D 結構和衣殼組裝過程
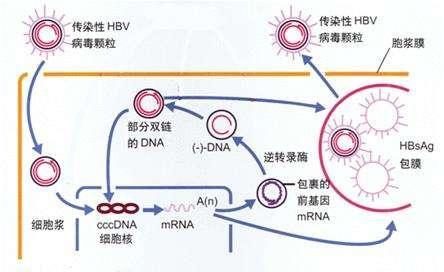
B肝核心蛋白,科研人員發現,它幾乎調節HBV生命周期每一步
法國斯特拉斯堡大學Inserm病毒與肝病研究所和 Aligos公司比利時子公司Aligos Belgium BV研究人員在臨床醫學雜誌Journal of Clinical Medicine(JCM)上發表了一項科學研究,研究重點闡述了衣殼組裝調節劑作為抗HBV抗病毒劑:分子機制和臨床開發前景。
研究人員介紹,儘管已有預防性B肝疫苗可用,但仍有超過2.5億人患有慢性HBV感染,這是導致肝病和HCC的主要原因。HBV感染人類肝細胞,並在其中建立其基因組,即具有染色體特徵的cccDNA。
已開發獲批療法可以控制HBV複製,但它們不足以根除cccDNA。核心蛋白,它是HBV核衣殼的組成部分。這種蛋白幾乎可以調節HBV生命周期的每一步驟;因此,它代表了開發新型抗病毒療法的一個有吸引力的方向。
來自JCM,圖 2. HBV 生命周期,可見CAM幾乎參與所有步驟!

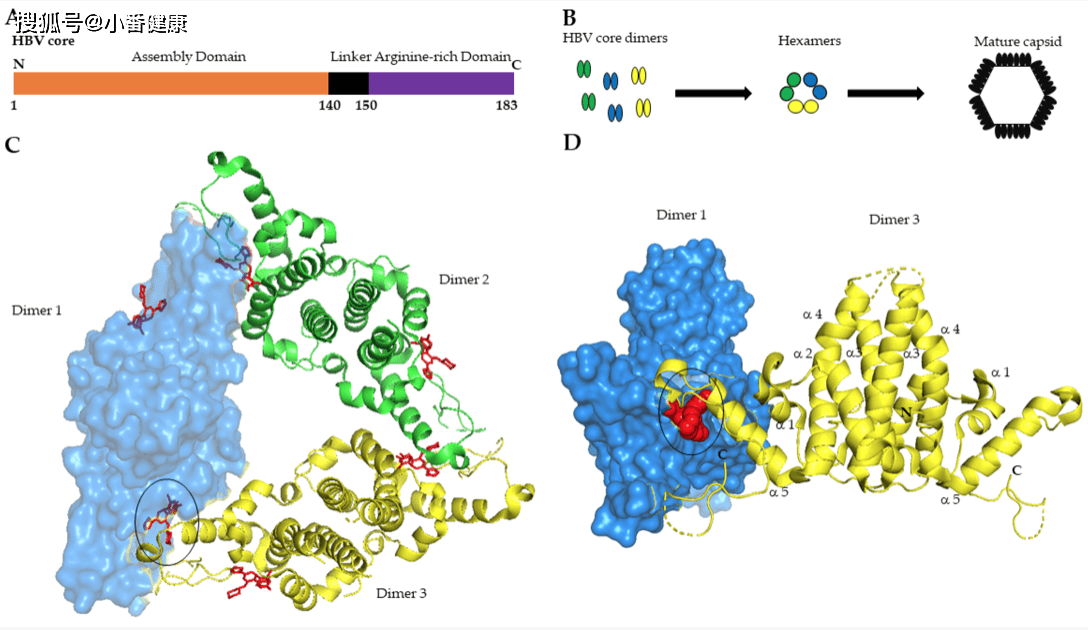
HBV核心蛋白,是一種對HBV生命周期至關重要的多功能蛋白。HBV核心蛋白或HBV核心抗原(HBcAg)是從pgRNA翻譯而來的183個氨基酸蛋白質。它包括三個不同的結構域:參與核衣殼組裝的富含α 螺旋的 N端結構域 (aa 1-140)、接頭區 (aa 141-149) 和富含精氨酸的 C 端結構域 (aa 150-183) ) 是病毒基因組複製所必需的。
從結構角度看,HBcAg構成了核衣殼結構的組成部分。翻譯後不久,核心組裝成同型二聚體,而三個同型二聚體相互作用形成二聚體的三聚體。結構研究揭示了核衣殼的結構。核心N端組裝結構域包含五個α-螺旋。核心蛋白的二聚化由在相互作用表面形成四螺旋束的兩個不同單體的 α-螺旋 3 和 4 之間的疏水邊界引導。
第61位的半胱氨酸在二聚體界面產生二硫鍵,然而,突變研究表明該殘基對於二聚體衣殼的形成不是必需的。另一方面,N端裝配域(α-螺旋 5)的遠端部分參與二聚體結合。成熟的衣殼由240個核心亞基因組組成,這是典型的 T = 4結構。在體外研究表明,衣殼組裝是一個微調的變構過程,其動力學嚴格取決於核心二聚體濃度、離子嚴格性和溫度。
衣殼組裝的初始步驟是一個緩慢過程,可確定核心二聚體的正確相互作用(成核步驟)以及pol-pgRNA 複合物的特異性結合和封裝。一旦這個複合物建立起來,完全成熟的核衣殼就形成了,而pgRNA可以在rcDNA中逆轉錄。正常核衣殼組裝的擾動,會強烈影響 pgRNA-pol 衣殼化。研究人員最近觀察發現,參與二聚體相互作用的核心 α-螺旋 5 中的特定突變,會影響衣殼組裝和 pgRNA-pol 衣殼化。
在本研究中,研究人員得出結論,pgRNA-pol 複合物與衣殼中間體相互作用,而不是與單個核心二聚體相互作用。
來自JCM雜誌,可見研究人員發表衣殼組裝調節劑作為抗HBV抗病毒劑:分子機制和臨床開發前景

小番健康結語:以上內容是要說明,本研究人員對B肝病毒核心蛋白的深入探索結果,結果發現核心蛋白對於B肝病毒整個生命周期都很關鍵,這就是本研究人員想要表達的核心觀點!
目前還沒有可通過消除受感染肝細胞中的cccDNA來有效治愈HBV慢性感染,因此,迫切需要開發能夠滅活或讓cccDNA清除的新療法。在這個背景下,全球科研人員發現HBV 核心蛋白可以代表一個新靶點,以開發衣殼組裝調節劑(CAM)或稱為核心蛋白變構調節劑(CpAM)。
若想有效治愈HBV,新目標是在治療結束後至少6個月內實現B肝表面抗原(HBsAg)持續清除,在這方面,衣殼組裝調節劑代表著一類有希望的化合物。根據目前已有CAM進入臨床開發數據看,在慢B肝受試者中,單用CAM或與其他抗病毒藥物組合使用顯示出對 HBVDNA和RNA的有效抗病毒活性。
此外,在細胞模型和小鼠動物模型中,一些CMA化學型在治療停止後,會導致HBsAg 持續清除!在未來,全球科研人員還會持續評估CAM分子在臨床研究中誘導HBsAg清除的潛力!(指長期研究)。本研究主要是在介紹HBV衣殼組裝調節劑的開發策略和前景,已發表在Journal of Clinical Medicine(JCM)上。返回搜狐,查看更多
責任編輯: