B肝病毒感染早期,由於未能誘導肝細胞內顯著的先天免疫反應和免疫抑製,導致受到感染肝細胞無法被完全清除,從而形成慢性感染。全球科研人員一些獨特觀察瞄向HBVDNA整合存在於宿主細胞基因組中,對HBVDNA整合可能會影響HBV複製、持久性以及發病機制等方向,都可能是未來科研課題。

B肝複製周期複雜,附著/進入肝細胞開始,精密裝配已在進行
慢性HBV感染開始於一般為無症狀非炎症期(或稱之為免疫耐受期)。這個狀態特點是高HBV血清滴度和低激活(沒有完全沉默)的HBV特異性CD8+T細胞。經歷十年後的慢性HBV感染後,HBV特異性CD8+T細胞會變得越來活躍,從感染進展到炎症階段,即可見的免疫介導的肝損傷和HBV滴度波動。血清轉化,預示著B肝病毒攜帶進入非活動期,但不是全部HBV感染肝細胞都被消除。
在這個階段,HBV滴度較低,肝損傷進展相比前一個階段免疫反應更緩慢。這個階段,B肝病毒複製有可能重新激活,導致慢性炎症和病毒學突破。少數慢性B肝患者(每年約有1%的HBeAg陰性者)清除病毒並進展到HBsAg陰性期,在此期HBV血清DNA無法檢測到,可以找到識別HBV表面抗原的抗體。像這種狀態,通常將其定義為功能性治愈,即疾病停止發展。

當然,功能性治愈還不是抗HBV終點,如在免疫抑製治療下曾觀察到重新激活,表明B肝病毒的共價閉合環狀DNA(cccDNA)仍然存在於肝髒中,但轉錄沉默。一般而言,HBV相關的終末期肝病(包括肝硬化和肝細胞癌)發生在暴露幾十年以後。HBV是由包膜病毒所組成,包膜病毒包含約3.2 kbp的松弛環狀雙鏈DNA(dsDNA)基因組,包膜病毒編碼衣殼,前期小番健康已有介紹。
B肝病毒複雜的複製周期,也是目前全球開發新藥的突破點,如B肝病毒從附著和進入肝細胞開始都可能作為靶點進而研發新藥。B肝病毒最初是通過病毒包膜內的B肝表面抗原與肝細胞表面的硫酸肝素蛋白多糖之間的低特異性相互作用而附著著。然後,在HBsAg的pres1結構域的75個n端氨基酸和牛磺膽酸鈉共轉運多肽(NTCP)之間,發生高度特異性的相互作用,NTCP是肝細胞特異性的膽鹽轉運體和HBV細胞受體。

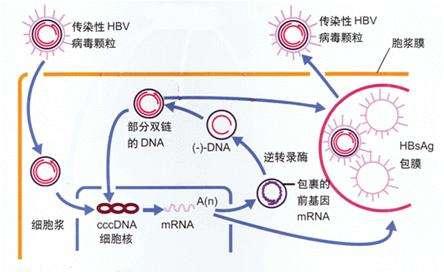
B肝病毒粒子經過受體介導進入後,含有松弛環狀DNA(rcDNA)基因組的核衣殼,被釋放到細胞質中,並運輸到核。利用涉及DNA修複機制成分的核宿主細胞因子,釋放的rcDNA被轉化為共價閉合環狀DNA(cccDNA),這是B肝病毒的信使RNA(mRNA)的穩定的外染色質轉錄模板。編碼結構蛋白和調控蛋白的亞基因組mRNA和大於基因組長度的前基因組RNA(pgRNA)均是由cccDNA轉錄。

pgRNA與病毒聚合酶,一起被包衣到病毒衣殼中。pgRNA通過一系列地複雜的步驟,在核衣殼內發生逆轉錄,形成rcDNA或雙鏈線性DNA(dslDNA)。在這一過程中,會形成許多複製中間體,在某些情況下,還會被分泌。HBV感染細胞產生的病毒,它們的主要形式是含有rcDNA的核衣殼,它們可以被包膜並作為病毒粒子分泌,或者循環回到細胞核,以現有未知的速度,增加或補充核內的cccDNA池。返回搜狐,查看更多
責任編輯: