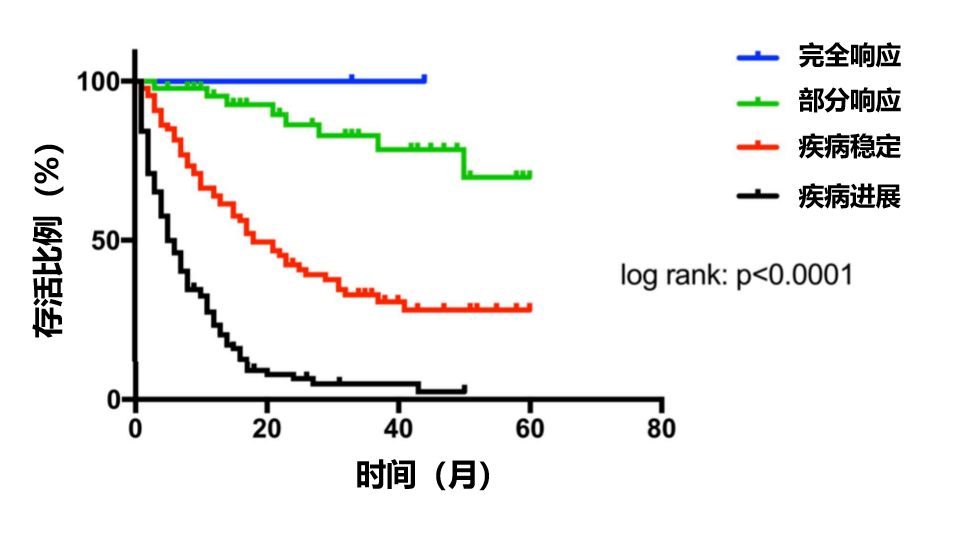
抗癌管家提示:邵為朋 王曉偉 劉德若 作者部門:100029 北京,北京大學中日友好臨床醫學院胸外科(通訊作者:劉德若,E-mail: [email protected])
【摘要】小細胞肺癌是一種致死率較高的惡性腫瘤,現階段的治療方式有手術,化療和放療,但預後極差。近些年來湧現的靶向治療和免疫治療也都在進行著大量的臨床試驗,本文將對小細胞肺癌目前的治療策略以及未來研究的方向進行綜述。
【關鍵詞】肺腫瘤; 手術;化療;放療;靶向治療;免疫治療
肺癌是我國最常見的惡性腫瘤,全國腫瘤登記中心2016年發布的數據顯示,肺癌在男性患者中佔據第一位,女性患者也僅次於乳腺癌[1]。主要類型包括非小細胞肺癌(non-small cell lung cancer, NSCLC)和小細胞肺癌(small cell lung cancer, SCLC), SCLC佔新發肺癌的10%-15%,是一種侵襲性較高的神經內分泌腫瘤,在臨床和病理特點上明顯不同於NSCLC,具有生長迅速、容易耐葯、較早轉移等特點,幾乎所有的SCLC患者都有嚴重吸煙史[2,3]。
1 SCLC目前主要治療策略

SCLC目前的治療方式主要有手術、化療、放療和尚未正式批準運用到臨床的免疫及靶向治療。由於SCLC的臨床特點,發現時已有遠處轉移,僅有約5%的SCLC患者能夠早期發現並能完成手術治療,而且手術治療僅適用於臨床分期I期(T1-2, N0),並且縱隔淋巴結未被侵犯的局限期SCLC患者[4]。對於手術方式的選擇肺葉切除優於肺段或楔形切除術(P=0.03)[5],腫瘤切除後推薦輔助化療或者放化療聯合治療[6]。化療是各種治療方式的基本組成部分,目前對於局限期一線化療方案主要為順鉑+依託泊苷(EP),廣泛期的化療方案主要有鉑類+伊立替康和EP方案,來自日本的III期臨床試驗發現對於廣泛期SCLC鉑類+伊立替康比EP方案的中位生存期更長(12.8 months vs 9.4 months, P=0.02)[7],然而與之相反另外一項III期臨床試驗2種治療方案並沒有顯著的臨床差異[8]。雖然SCLC對化療敏感,歡迎大家搜索 抗癌管家互助群,加入抗癌管家互助群和大家多交流。但化療後容易產生耐葯和複發,複發時間間隔大於6個月的繼續應用原方案,間隔小於6個月的根據化療後複發的情況二線化療方案主要有拓撲替康、伊立替康、紫杉醇、多西紫杉醇、口服依託泊苷、吉西他濱、及諾維本等藥物[9]。胸部放療可以提高局限期SCLC患者的生存率,放化療聯合治療相比化療單葯治療更能使患者獲益,但傳統的放化療對於局限期SCLC患者的長期生存仍是巨大的挑戰,對於廣泛期SCLC患者,有研究表明若患者對化療有反應,可以順序施加放療,一項III期臨床試驗發現化療後再放療相比沒有接受放療的患者並沒有提高1年的總生存率(33% vs 28%, P=0.066),但提高了2年的總生存率(13% vs 3%, P=0.004) [10]。超過50%的SCLC患者會發生腦轉移,預防性腦照射(prophylactic cranial irradiation, PCI)可以阻止腦轉移的發生,治療中發揮著重要作用,一項回顧性臨床研究發現PCI對比沒有PCI的局限期SCLC患者更能提高其生存率,同步放化療是治療SCLC的標準方案,放療應儘早應用到SCLC的治療中,在1個-2個化療周期後即可開始放療,縮短任何治療方式同放射治療的間隔,均可明顯提高患者的生存率[11],對於廣泛期SCLC患者,結果令人失望,一項來自日本的III期臨床試驗PCI後並不能提高其生存率[12]。關於腫瘤標記物相關臨床試驗發現核小體,胃泌素釋放肽(gastrin releasing peptide, ProGRP)、神經元特異性烯醇化酶(neuron specific enolase, NSE)、細胞角蛋白19片段(cytokeratin 19 fragment, CYFRA21-1)腫瘤標記物在初始治療過程保持在較高的水準或者下降不明顯會有較差的治療結果, 這些腫瘤標記物或許可以在治療周期中作為療效的監測方式[13]。放化療及手術均為SCLC的主要治療方式,但SCLC的總體生存率仍較低,現有的治療方式已達到瓶頸,但隨著生物免疫靶向治療方式的出現,SCLC的患者或許能見到一絲曙光。
2 SCLC靶向治療研究進展
靶向治療的原理是通過在基因分子層面改變腫瘤的信號傳導途徑、影響血管生成等各種方式從而抑製腫瘤細胞的生長。靶向藥物[如針對錶皮生長因子受體(epidermal growth factor receptor, EGFR)突變和間變性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因重排]在NSCLC中已經得到廣泛應用,可以顯著改善患者的預後及生存品質。SCLC基因組中表現了較高的基因突變率,如TP53、RB1、NOCTH家族的失活性突變,TP73的基因突變和基因組重排,EGFR、KRAS的激活性突變,MYC擴增[14,15]。相關研究完成了大量的臨床試驗,但仍沒有明確針對此肺癌亞型的靶向藥物。在本節中,我們重點報導在基因層面的臨床試驗和有針對性的方法,以研究SCLC的靶向治療的未來方向。
2.1 酪氨酸激酶受體(receptor tyrosine kinases, RTKs)
RTKs是細胞信號傳遞過程的關鍵調控因子,在細胞增殖和分化、細胞的生存和代謝、器官形態、新生血管形成、細胞遷移、組織修復和再生定義中起著重要作用[16]。異常RTKs信號是腫瘤起始和進展的重要特徵,所以RTKs可以作為未來研究SCLC的重要分子靶點。
2.1.1 c-KIT抑製劑 c-KIT抑製劑如甲磺酸伊馬替尼(imatinib mesylate)通過佔領酪氨酸激酶與ATP結合位點從而抑製酪氨酸激酶活性,伊馬替尼活性與9號和11號外顯子突變相關,此類基因突變在胃腸間質瘤中比較常見[17]。在一項II期臨床試驗中,入組19例患者,分別將伊馬替尼用到廣泛期SCLC和化療後複發的SCLC 2組患者中,伊馬替尼不能有效控制疾病進展,並且只有21%腫瘤樣本中表達c-kit[18]。在另外一項II期臨床試驗中,收集29例入組標準為c-kit陽性的SCLC患者,c-kit抑製劑同樣未能證實其臨床效果[19]。
2.1.2 EGFR抑製劑(EGFR tyrosine kinase inhibitors, EGFRTKIs)EGFR在許多腫瘤細胞中過度表達,在NSCLC中靶向藥物已經運用到臨床,而在SCLC中EGFR則表達較少甚至不表達[20]。在一項II期臨床試驗中,納入20例SCLC患者,接受EGFR-TKIs吉非替尼治療後,無患者獲得完全緩解(complete response, CR)或者部分緩解(partial response, PR),2例患者獲得疾病穩定(stable disease, SD),其餘患者均發生不同程度的疾病進展(progressive disease, PD),此項研究並未證明EGFR-TKIs能夠抑製腫瘤的生長,作者認為SCLC的生長或許並不依賴細胞增殖周期中的EGFR的表達[21]。
2.1.3 胰島素樣生長因子 [insulin-like growth factor-1(IGF1)/IGF-1 receptor (IGF-1R)] IGF1/ IGF-1R是一種惡性腫瘤表達的啟動子,通過PI3K/Akt和MAPK通路傳遞信號,通過抑製PI3K/AKT和MAPK通路可以增強化療的效果。一項臨床研究證明IGF1/IGF-1R抑製劑同步聯合鉑類化療葯以及放療可以明顯提高患者總生存率[22]。IGF1/IGF-1R抑製劑在動物模型實驗中可使腫瘤獲得明顯的縮小,或許此類葯可以進行下一步的臨床試驗[23]。
2.1.4 成纖維細胞生長因子受體(fibroblast growth factor receptor, FGFR) FGFR通過受體間相互作用來介導胚胎的發育,在組織的修復以及系統的動態平衡中起著重要作用。在乳腺癌、食管癌以及頭頸部癌較常見編碼FGFR的基因改變(如基因擴增、突變、移位和表達增加)[24],Schultheis等[25]研究發現大約有5%的SCLC患者中FGFR-1高表達,應該積極推進關於FGFR抑製劑的臨床試驗研究[26]。在體內外試驗中應用FGFR抑製劑可以抑製SCLC細胞的生長,或許能為SCLC提供新的思路。
2.1.5 MET抑製劑 MET也是一種RTKs,在SCLC中過度表達,通過HGF/MET軸發揮作用,對正常細胞和惡性細胞的信號傳遞均發揮重要作用。一項對照試驗表明,MET抑製劑聯合拓撲異構酶抑製劑均比兩項單葯治療能夠明顯縮小腫瘤的大小(P<0.05),為SCLC患者的治療提供了潛在的有效的措施[27]。
2.2 靶向Hedgehog(Hh)通路

Hh通路分泌的蛋白質參與調節細胞的生長、分化和增殖,然而如果通路由於異常的基因突變或者其他機制導致其在成人器官或者組織中過度活躍,對於各個器官腫瘤的發生尤其是肺組織起了重要作用[28]。Park等[29]利用小鼠模型,通過敲除小鼠的Rb1和Trp53基因誘導SCLC的發生,發現Hh通路是影響SCLC細胞微環境的獨立因素,藥物阻斷Hh通路可以抑製SCLC的生長,為SCLC的靶向藥物治療提供了新的方向,而且很多Hh通路抑製劑正處於臨床試驗中。
2.3 PI3K/AKT/mTOR通路
PI3K/AKT/mTOR通路參與細胞增殖、分化、凋亡和葡萄糖轉運等多種細胞功能的調節,通路活性的增加常與多種癌症的發生相關。一項來自日本的回顧性研究篩選了從1992年-2012年間1,042例SCLC患者,共有55例SCLC入組,研究發現鹼基G與鹼基T間的替換是主要的突變類型,大約有40%的SCLC患者有PI3K/AKT/mTOR通路的異常,並且在體外應用此通路抑製劑可以明顯減弱SCLC的增殖[30]。PI3K/AKT/mTOR通路抑製劑如everolimus和temsirolimus都正在處於II期臨床試驗中,並且everolimus已經運用到腎細胞癌的靶向治療中[31,32]。
2.4 血管生成通路
血管的生成對腫瘤的生長以及遠處播散起到了關鍵作用,血管內皮生長因子(vascular endothelial growth factor, VEGF)是血管在正常生理情況和異常病理情況的關鍵參與者。貝伐珠單抗(Bevacizumab, Bev)是重組人源化抗VEGF的單克隆抗體,已被批準用於一線治療幾種實體腫瘤,例如NSCLC、乳腺癌、結腸癌、腎細胞癌和卵巢癌。Trafalis等[33]II期臨床試驗,以順鉑+依託泊苷治療後複發的病例,歡迎大家搜索 抗癌管家互助群,加入抗癌管家互助群和大家多交流。採用伊立替康+貝伐珠單抗二線治療,總體反應率(overall response rate, ORR)包括PR和CR為25%(95%CI: 8.9-41.0),SD患者2個月總疾病控制率為89%(95%CI: 77.41-100),中位反應時間為6個月,中位數無進展生存期為3個月(mean PFS: 3.2 months, 95%CI: 2.7-3.7),6個月的無進展生存率3.6%,1年OS率為3.6%,認為化療後複發的SCLC患者合用貝伐珠單抗是一種有效的治療措施,但進一步的大規模的研究仍是有必要的。一項更大數量的多中心、III期、隨機對照臨床試驗研究對比順鉑+依託泊苷與順鉑+依託泊苷+貝伐珠單抗作為一線治療廣泛期SCLC,204例SCLC患者入組,隨機分為2組,中位隨訪期為34.9個月,2組中位OS分別為8.9個月和9.8個月,1年生存率為25%和37%(HR=0.78; 95%CI: 0.58-1.06; P=0.113),接受貝伐珠單抗的患者的OS有顯著的統計學差異(HR=0.60; 95%CI: 0.40-0.91; P=0.011),中位PFS分別為5.7個月和6.7個月(P=0.030),在一線治療中加入貝伐珠單抗組PFS有獲益,OS只在少數維持治療的患者中獲益[34]。貝伐珠單抗從試驗到臨床應用仍需大量的臨床研究來證實其安全性、有效性。
2.5 Aurora激酶抑製劑
Aurora激酶是負責調控細胞有絲分裂的一類重要的絲氨酸/蘇氨酸激酶,異常表達(比如Rb基因的失活,MYC家族的擴增)的Aurora激酶往往會導致細胞在有絲分裂的過程中出現大量的異常現象,Ba rba ra等在體內外試驗發現SCLC基因中MYC的擴增或者高度表達將會對Baraser tib(Aurora激酶抑製劑)有較高的反應,MYC的表達產物可作為對SCLC的療效預測標記物[35]。Mollaoglu等[36]通過使小鼠MYC基因表達同時Rb1和Trp53基因的缺失造成小鼠多發轉移、侵襲性較強狀態的腫瘤,並用類似人類SCLC的化療藥物進行治療,之後聯合Aurora激酶抑製劑可以明顯壓製腫瘤的進展和提高生存率。
2.6 PARP抑製劑

PARP是一種多功能蛋白翻譯後修飾酶,在DNA損傷修復和細胞凋亡中發揮著重要作用,通過識別結構損傷的DNA片段而被激活,被視為DNA損傷的感受器[37]。體外研究發現在SCLC中PARP的水準會上調,上調的水準與其對PARP抑製劑的敏感性相關[38]。Lok等[39]發現在體內試驗中SLFN11可以作為PARP抑製劑的療效評價指標,替莫唑胺已被推薦SCLC複發轉移的治療方案,PARP抑製劑聯合替莫唑胺可以使SCLC增加控制的程度,並且可以減少單葯治療的不良反應。但是未來的臨床研究仍需要證實這項臨床前期研究。Stewart等[40]通過體外試驗發現在應用卡鉑聯合PARP抑製劑時,可以使體外試驗獲得明顯獲益並且可以通過SLFN11、EMT和ATM三種療效預測標記物的變化來預測其效果。
2.7 抗偶聯藥物Rov a -T
抗偶聯藥物Rova-T是針對DLL-3(Delta-like ligand 3)蛋白表達的靶向製劑,DLL-3 蛋白參與腫瘤乾細胞的調節, 高度表達在神經內分泌腫瘤的乾細胞表面。Rovalpituzumabtesirine(Rova-T)是抗DLL3蛋白抗體Rovalpituzumab與細胞毒素Tesirine的偶聯藥物。Saunders等[41]已經完成了體內的1期臨床研究,Rova-T對SCLC具有一定的抗腫瘤活性,為下一步2期研究奠定了基礎,並且DLL-3蛋白可以作為SCLC的療效預測標誌物。
3 SCLC免疫治療研究進展
目前針對SCLC患者的治療仍然是沿用30年來一致的以放化療為主的治療,雖然最近靶向治療的藥物越來越多的進行了臨床試驗,但距離運用到臨床仍然需要一定的時間,這就迫使臨床醫生研究新的治療方式和方法,隨著分子生物學、免疫學及基因工程技術在腫瘤學中的研究深入和應用,腫瘤免疫治療已經成為腫瘤治療領域的研究熱點。近年來在肺癌領域很多免疫治療也隨之發展,到目前為止,免疫檢查點抑製劑(immune checkpoint inhibitors)通過抑製腫瘤細胞逃避免疫監視和識別的作用,成為免疫治療最有前景的方式。
3.1 程式性死亡受體-1(programmed cell death protein-1, PD-1)
Schultheis等[42]研究94例SCLC患者發現腫瘤細胞的PD-1受體均為陰性,而腫瘤的間質細胞(腫瘤浸潤的巨噬細胞和淋巴細胞)則發現了受體的表達,抗PD-1抗體或許對腫瘤間質表達PD-1的SCLC發揮作用,並且作者認為腫瘤微環境的研究應該被納入臨床試驗。但Komiya對上述研究提出了反對意見,通過對99例SCLC患者分析,得出有82例患者表達陽性結果即有PD-1表達,如此高的陽性率得到了Ishii等研究的支持,Ishii等通過免疫組化分析102例SCLC 患者,其中73例(71.6%)表達 PD-1,SCLC患者PD-1陽性的明顯比陰性的有更好的OS,與PFS沒有直接的關係[43,44]。而Chang等[45]研究PD-1在腫瘤細胞和腫瘤浸潤的淋巴細胞分別為78.0% 和54.3%,與Ishii相反的是PD-1陽性的SCLC患者中卻為更差的OS。
3.2 細胞毒性T淋巴細胞抗原-4(cytotoxic T lymphocyte antigen 4, CTLA-4)
CTLA-4作用機制和PD-1類似,通過參與免疫反應的負調節來發揮作用。伊匹單抗(ipilimumab)是一種抗CTLA-4的單克隆抗體,已被美國食品和藥物管理局(Food and Drug Administration, FDA)批準運用到惡性黑色素瘤的免疫治療。SCLC的相關研究也逐漸進行,Reck等[46]納入334例SCLC患者行II期臨床試驗認為伊匹單抗聯合紫杉醇+卡鉑對比單用紫杉醇+卡鉑可以延長OS(12.9個月 vs 9.9個月;HR=0.75;P=0.13),同時可以提高免疫相關PFS(immune-related PFS, irPFS)(HR=0.64; P=0.03)。隨後Reck等又做了一項1,132例SCLC患者的III期臨床試驗,化療藥物+伊匹單抗與化療藥物+安慰劑的中位OS分別為11.0個月和10.9個月(HR=0.94; 95%CI: 0.81-1.09; P=0.377,5),中位PFS分別為4.6個月和4.4個月(HR=0.85; 95%CI: 0.75-0.97),化療過程中加入伊匹單抗並不能提高患者OS,不過仍有大量的關於CTLA-4臨床試驗正在進行中:一線化療後SCLC的進一步研究(NCT02538666);抗PD-1抗體(Nivolumab)和抗CTLA-4抗體(Ipilimumab)聯合在LDSCLC中臨床試驗(NCT02046733)[47]。
單一方式治療SCLC較為困難並且容易耐葯,患者要承受單葯大劑量帶來的耐藥性及嚴重不良反應,所以各種方式的聯合治療已有相關研究發現這種方式的優點。Konstantinos等[48]進行的化療後加入免疫治療藥物的II期隨機對照研究,納入164例患者,歡迎大家搜索 抗癌管家互助群,加入抗癌管家互助群和大家多交流。試驗發現僅有局限期SCLC患者應用IFN-α組出現P<0.05。Antonia等[49]發表了一項多中心、開放的I期/II期臨床試驗,216例患者納入試驗,分成Nivolumab單葯和nivolumab+ipilimumab聯合,單葯組有10%的反應率、32%的疾病控制率、1年生存率33%,聯合組有19%-23%的反應率、36%-42%的疾病控制率、1年生存率35%-43%,這些數據表明在有限的治療措施中2種免疫藥物聯合不失為一種可供選擇的治療[50]。相比其他腫瘤,SCLC的PD-L1陽性率極低,或許2葯聯合中ipilimumab激活了nivolumab的活性。但在另外一項III期臨床試驗中,將SCLC患者分成ipilimumab單葯和ipilimumab聯合化療藥物,對比各項發現2組並沒有明顯的臨床療效差別,這就意味著ipilimumab在SCLC中發揮著有限的作用。
4 SCLC的其他藥物
阿司匹林作為一種老葯新用,已被證實可以通過抑製環氧合酶和減少攝護腺素的合成來減少結直腸癌的發病率和死亡率[50]。長期觀察發現阿司匹林的應用在其他腫瘤包括肺癌同樣可以減少死亡率,所以一項關於SCLC的前瞻性隊列研究系統地研究了阿司匹林的作用,作者發現長期低劑量的服用阿司匹林並不能提高SCLC患者的生存率,或許與SCLC中環氧合酶-2低水準有關[51]。
5 結語
目前針對SCLC的治療仍然是延續近30年傳統的放化療為基礎的治療,鑒於SCLC的異質性以及基因組的複雜性,首先要從診斷入手提高SCLC的診出率,比如聯合傳統的細胞學、免疫組化、二代測序甚至三代測序等方式。其次針對當下的靶向藥物的臨床試驗並不能明顯改善患者的預後以及免疫治療的蓬勃發展,多方式綜合治療即放化療+靶向治療+免疫治療或許可以給SCLC患者帶來一線生機。最後,SCLC在分子病理的機制仍未完全明確,仍需技術的進步給予分子層面的解釋,仍需大量的臨床試驗進行新葯的研發,仍需新的治療策略指導臨床實踐。
參 考 文 獻
詳見《中國肺癌雜誌》2 0 1 7年6月第20卷第6期 Chin J Lung Cancer, June 2017, Vol.20, No.6
本文轉自中國肺癌雜誌,由抗癌管家編輯整理。
抗癌管家是專門幫助廣大癌症患者提供前沿抗癌資訊的互助平台,現已開通患者交流群,歡迎大家搜索抗癌管家互助群,加入抗癌管家互助群和大家多交流。祝願每個患者和家屬都健康平安。抗癌管家-你身邊的抗癌專家。