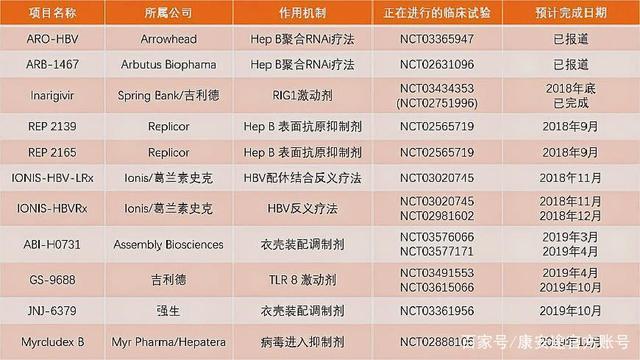
由箭頭製藥(Arrowhead Pharmaceuticals)於2020年8月18日最近更新的臨床試驗,B肝在研新藥ARO-HBV在健康志願者與慢性B肝(CHB)患者中的I/II期研究。本研究評價單劑量和多劑量的ARO-HBV(JNJ-3989),在健康者和慢性B肝患者中的安全性、耐受性、藥代動力學以及藥效學。

B肝在研新藥ARO-HBV,靶向RNAi,快速進入IIb期
ARO-HBV的劑型為注射液,本研究安慰劑是無菌生理鹽水(0.9%NaCl),臨床試驗編號:NCT03365947。第一和第二階段研究設計共納入114名符合條件受試者,本研究實際開始日期:2018年3月27日,實際初步完成日期:2019年9月10日,實際研究完成日期:2020年4月23日。試驗設計方法如下:手臂乾預/治療,活性對照物:ARO-HBV注射液藥物:ARO-HBV注射液,採用單劑量或多劑量皮下注射ARO-HBV。
研究人員關注的主要結果指標包括最多203天時,可能或可能與治療有關的不良事件(AE)的參與者人數。次要結果指標包括ARO-HBV的藥代動力學(PK):在給藥後48小時,僅A部分(單次遞增劑量[SAD]階段;最大觀察血漿濃度(Cmax);ARO-HBV的PK:給藥後48小時,僅A部分(SAD階段)達到最高血漿濃度(Tmax)的時間;ARO-HBV的PK:從0到24小時血漿濃度-時間曲線下的面積(AUC0-24);

給藥後48小時,ARO-HBV的PK:從零到無窮大的血漿濃度-時間曲線下的面積(AUCinf);僅A部分(SAD階段)中,ARO-HBV的PK:終末消除半衰期(t½);最多113天B部分(僅限多次遞增劑量[MAD]階段),慢性B肝病毒感染者的B肝表面抗原,從給藥前1天到給藥後最低點的降低。本研究是一項Plase1和Plase2共同進行的臨床研究,接受健康志願者入組。
入選標準:18歲至65歲成人或老年人的健康志願者、慢性B肝患者;A部分和B部分的納入標準:具有生育潛力的婦女必須有妊娠試驗陰性,不能哺乳,並且必須願意避孕。願意提供書面知情同意書並遵守研究要求。B部分的附加納入標準:慢性B肝病毒感染的診斷篩查時,B肝表面抗原應大於50 IU/mL;肝髒彈性成像評分需小於或等於10.5。

排除標準:具有臨床意義的健康問題,但B部分患者的慢性B肝病毒感染者除外;任何被認為具有臨床意義的臨床安全實驗室結果異常;篩查前1個月內經常飲酒者;最近使用非法藥物;在給藥前30天內,或目前參與研究研究前30天內使用研究藥物或設備;注:根據研究方案,可採用其他納入/排除標準。研究歷時2年,是一項I期、IIa期共同進行並已經完成的B肝在研新藥臨床試驗。
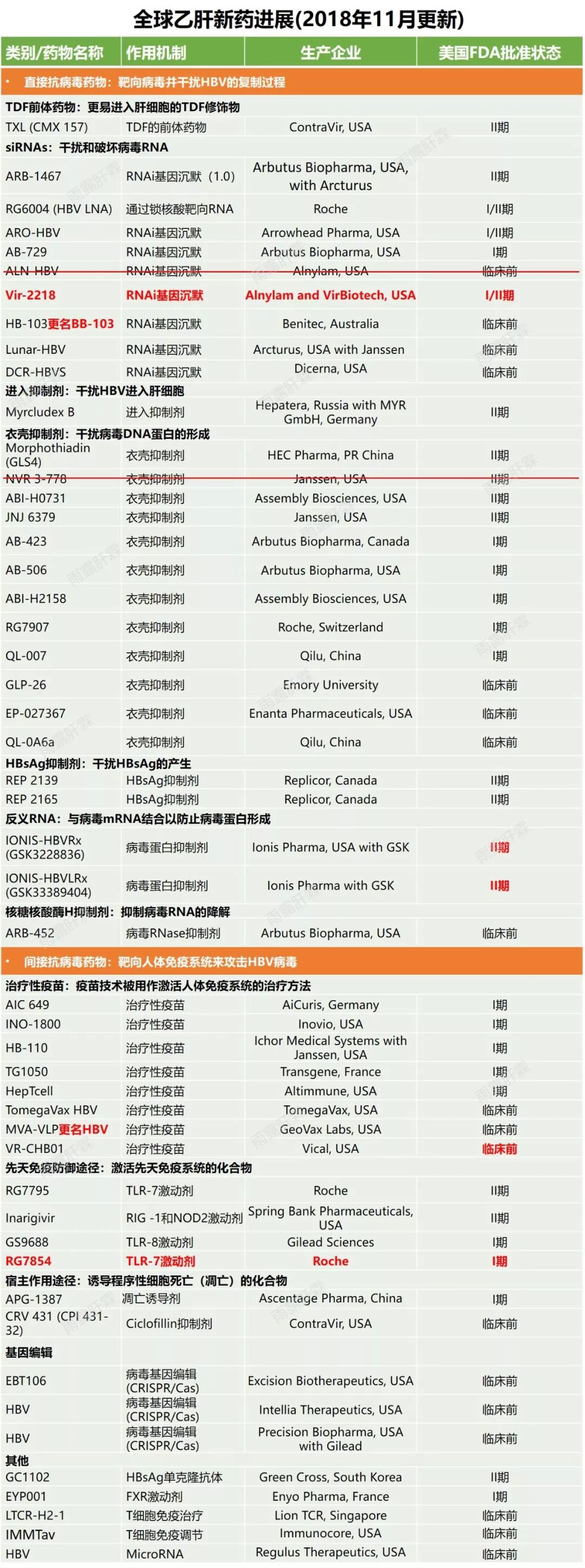
此外,研究藥物ARO-HBV,也稱為JNJ-3989,該藥當前已經進入IIb期臨床試驗(在研中研發進度較快之一)。ARO-HBV(JNJ-3989)是一種基於RNAi療法研究藥物,使用靶向RNAi分子TRiMTM技術開發。2018年末,箭頭製藥(Arrowhead)已與強生子公司楊森製藥(Janssen Pharmaceuticals)共同研發該藥。
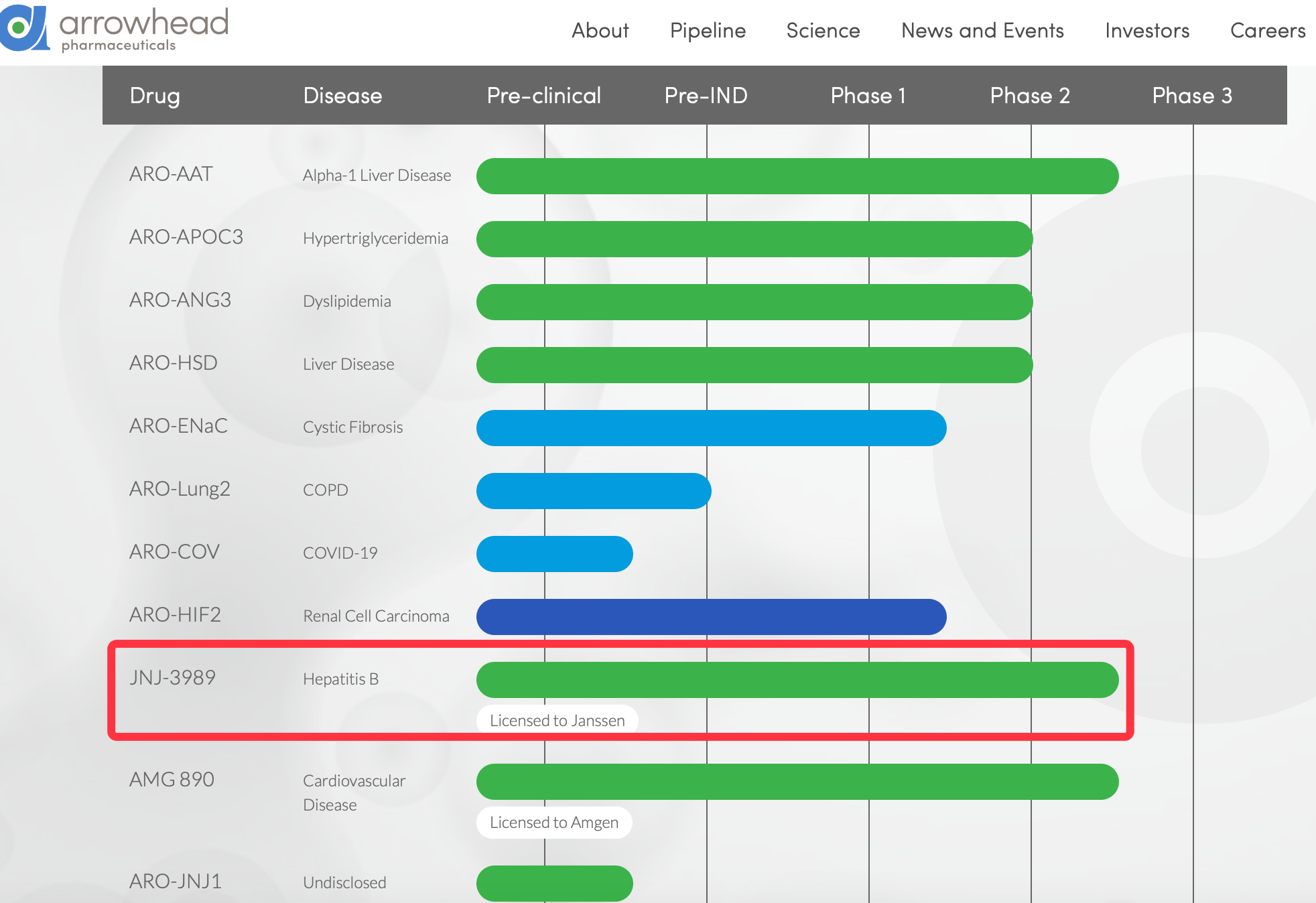
小番健康結語:以上臨床試驗設計登記在美國臨床試驗數據庫,介紹的是RNAi在研B肝新藥ARO-HBV(JNJ-3989)的I期/IIa期在健康志願者和慢性B肝患者中評估安全性、耐受性、藥代動力學以及藥效學。上圖為箭頭製藥研發管線,紅色框標注為該藥最新進展至IIb期研究。本研究結論:IIa期隊列2B-5B受試者每月注射一次100毫克、200毫克、300毫克、400毫克的JNJ-3989,B肝表面抗原的平均最大log10降幅分別是:1.9logs、1.7logs、1.7logs、2.0 logs。在更頻繁給藥(單周或連續兩周1次)(隊列6、7、10、11)未增加B肝表面抗原敲低的進展。未報告嚴重的不良事件或終止治療事件。返回搜狐,查看更多
責任編輯: